骨髓中(zhōng)的造血幹細胞,一部分(fēn)在胸腺中(zhōng)發育成T淋巴細胞,一部分(fēn)在骨髓中(zhōng)發育成B淋巴細胞。T細胞在體(tǐ)液免疫和細胞免疫均發揮作(zuò)用(yòng),且可(kě)分(fēn)泌淋巴因子;B細胞隻在體(tǐ)液免疫發揮作(zuò)用(yòng)。人體(tǐ)大多(duō)數免疫反應都是由細胞免疫和體(tǐ)液免疫共同完成的。
B細胞和T細胞的發現,被認為(wèi)是現代免疫學(xué)的起點。然而,其發現者 Cooper 和 Miller 卻在半個世紀裏備受諾貝爾獎的冷落,即便2018年的諾貝爾生理(lǐ)學(xué)或醫(yī)學(xué)獎正是建立在其基礎之上。這引起一些學(xué)者的不平,來聽聽他(tā)們的解讀吧。
提到免疫系統,相信大家都不陌生,它負責抵禦外來病原體(tǐ)的攻擊以及肅清人體(tǐ)内變異細胞的反叛,維護我們身體(tǐ)的正常運轉。
實際上,人類對于免疫系統的認識經曆了漫長(cháng)的過程,直到半個世紀前,免疫才真正發展為(wèi)一門學(xué)科(kē),而其中(zhōng)的起始點便是T細胞和B細胞的發現。
T細胞和B細胞的作(zuò)用(yòng)之重要以及用(yòng)途之廣泛,讓它們被發現之後的免疫學(xué)研究産(chǎn)生了翻天覆地的變化。2018年諾貝爾生理(lǐ)學(xué)或醫(yī)學(xué)獎就頒給了腫瘤免疫治療方向,而這種治療的原理(lǐ)正是通過釋放被癌細胞抑制的T細胞功能(néng),來達到治療癌症的目的。
然而,令所有(yǒu)人不解的是,T細胞和B細胞的發現者,Max D. Cooper和Jacques Miller,竟然一直與諾獎無緣。

圖:Max D. Cooper(左)和Jacques Mille(右)
免疫系統的發育過程受到精(jīng)确的調控,它的運轉機制也毫不亞于一本情節錯綜複雜的長(cháng)篇小(xiǎo)說。由于篇幅限制,今天的文(wén)章中(zhōng)我們隻詳細介紹其中(zhōng)的兩種非常重要的細胞,T細胞和B細胞。
T細胞和B細胞都是通過精(jīng)确制導對病原進行打擊的細胞類型,但是由于工(gōng)作(zuò)機制的不同,它們并不是經常一起出現。講一個故事讓大家感受一下它們的實力,其中(zhōng)先讓B細胞客串一下反派:
一個叫Emily的小(xiǎo)姑娘在她5歲的時候得了急性淋巴細胞白血病,她體(tǐ)内肆虐的是一種惡性B細胞。這種病在兒童中(zhōng)比較多(duō)見,也有(yǒu)85%的病人在經過兩輪化療之後就可(kě)以痊愈,甚至都不需要去做骨髓移植。可(kě)惜Emily不是那幸運的85%之一,她體(tǐ)内的惡性B細胞,甚至躲過了高強度化療的剿滅。走投無路的醫(yī)生和科(kē)學(xué)家嘗試了一種實驗性的方法,取出她的T細胞進行改造,然後派它們去她身體(tǐ)裏清除了惡性B細胞并守護她至今。這便是CAR-T療法最經典的故事。
這裏需要先為(wèi)B細胞正個名(míng)。健康人體(tǐ)内的B細胞并不是壞人,反而是我們免疫系統當中(zhōng)非常重要的組成部分(fēn)。B細胞的“B”來源于它第一次被發現的動物(wù)器官——鳥類的法氏囊Bursa of Fabricius(并不是”笨蛋”的B,在此要特别提醒看過《工(gōng)作(zuò)細胞》的童鞋們),它負責的部分(fēn)被稱為(wèi)體(tǐ)液免疫,其最重要的功能(néng)就是制造抗體(tǐ)。
而T細胞的T來源于它們的主要發育場所——胸腺thymus,在免疫系統中(zhōng)負責的工(gōng)作(zuò)被稱為(wèi)細胞免疫。T細胞基本分(fēn)為(wèi)兩種類型:一種攜帶CD4分(fēn)子,被稱為(wèi)輔助性T細胞(Th),也叫做CD4+T細胞,負責幫助其他(tā)免疫細胞的工(gōng)作(zuò);另一種攜帶CD8分(fēn)子,被稱為(wèi)殺傷性T細胞(CTL),也叫做CD8+T細胞,負責殺死不正常的人體(tǐ)自身細胞。
最早發現B細胞在鳥類的法氏囊中(zhōng)産(chǎn)生的人就是Max D. Cooper。他(tā)用(yòng)雞做實驗,發現切除掉法氏囊并接受X射線(xiàn)照射的雛雞體(tǐ)内完全沒有(yǒu)抗體(tǐ)産(chǎn)生。之後通過切除雞的胸腺,他(tā)又(yòu)發現了胸腺是T細胞的發生場所。
Jacques Miller的實驗動物(wù)則是現在都被廣泛使用(yòng)的小(xiǎo)鼠。他(tā)發現小(xiǎo)鼠被切除胸腺之後喪失了對異體(tǐ)器官的排異反應,也由此鑒定出人類最後一個未被認識的器官——胸腺的功能(néng)。此後,他(tā)鑒定出淋巴細胞分(fēn)為(wèi)T細胞和B細胞兩個類群,分(fēn)别源自小(xiǎo)鼠胸腺和骨髓。
3 B細胞和T細胞如何在人體(tǐ)内發揮效用(yòng)?
作(zuò)為(wèi)哺乳動物(wù)的一員,人類B細胞的祖先在我們的骨髓裏發育分(fēn)化,經過基因重排等等過程,讓成熟的每一個B細胞都帶一種能(néng)識别不同物(wù)質(zhì)結構的蛋白分(fēn)子,稱為(wèi)B細胞受體(tǐ)(BCR)。當有(yǒu)病原入侵我們,遇上帶着能(néng)識别它的受體(tǐ)的B細胞,這個B細胞就會複制自己,并且制造更多(duō)受體(tǐ)(此時被稱為(wèi)抗體(tǐ))分(fēn)泌出去,如同拿(ná)着匕首的忍者扔出飛刀(dāo)。
抗體(tǐ)飛出去結合在病原上,可(kě)以直接殺死或者幫助其他(tā)免疫細胞殺死這些病原。當病原被清除,失去了目标的B細胞大多(duō)數會自然滅亡,留下少部分(fēn)分(fēn)泌抗體(tǐ)在體(tǐ)内巡邏一段時間。我們注射的大部分(fēn)疫苗也是利用(yòng)了體(tǐ)内的B細胞,讓它們識别與病原體(tǐ)有(yǒu)相同結構的疫苗,然後制造出在體(tǐ)内巡邏的B細胞和抗體(tǐ),保護我們不受真正病原的侵害。
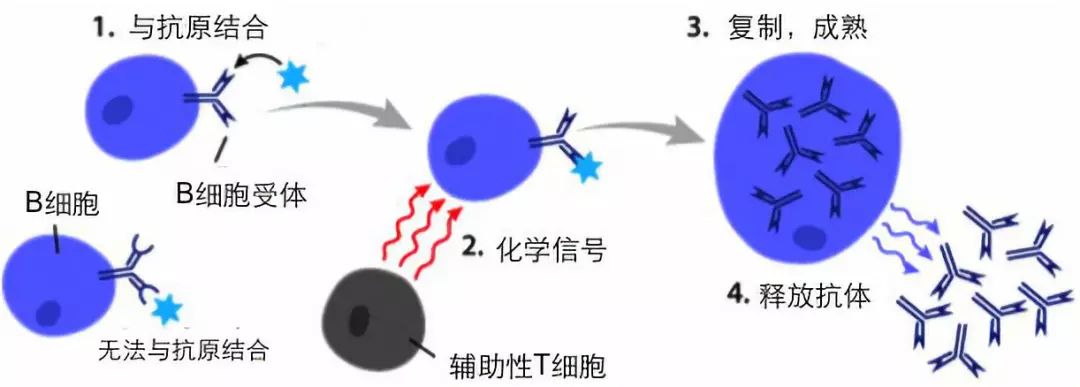
圖:B細胞執行功能(néng)的過程,複制受體(tǐ)識别和消滅病原
T細胞的成長(cháng)過程跟B細胞非常相似:T細胞的祖先從骨髓移動到胸腺,然後發育分(fēn)化,每一個成熟的T細胞也是帶着不同的T細胞受體(tǐ)(TCR)在體(tǐ)内巡邏。T細胞不會自己去識别病原體(tǐ),它需要抗原呈遞細胞将處理(lǐ)好的病原碎片交給它。Th細胞在識别病原之後,會迅速增殖成熟并制造大量細胞因子,輔助其他(tā)類型的免疫細胞,例如B細胞和殺傷性T細胞。
剛才我們的故事中(zhōng)Emily被改造的T細胞就是殺傷性T細胞,它們被激活之後可(kě)以殺死人體(tǐ)内被感染的細胞和癌變的細胞。
被病原體(tǐ)感染的細胞非常好辦(bàn),隻要它們表面上帶了不屬于人體(tǐ)的物(wù)質(zhì),殺傷性T細胞就會識别它們并将其殺死。而癌變的細胞就要狡猾得多(duō),他(tā)們攜帶的物(wù)質(zhì)絕大部分(fēn)都是人體(tǐ)内本身存在的物(wù)質(zhì),隻是跟正常細胞有(yǒu)數量上的差别,而正常的免疫細胞不會識别或殺死自體(tǐ)的細胞,這就是癌細胞常常得以逃脫免疫監控的原因。
在我們之前提到的案例中(zhōng),科(kē)學(xué)家通過改造Emily的殺傷性T細胞,賦予它們識别一個隻在B細胞表面出現的分(fēn)子——CD19的能(néng)力。被改造過的細胞叫做CAR-T細胞(chimeric antigen receptor T-cell,嵌合抗原受體(tǐ)T細胞),它們将Emily體(tǐ)内的B細胞全部清除掉之後,還留有(yǒu)一少部分(fēn)一直巡邏,以防惡性B細胞卷土重來。雖然正常的B細胞也同樣犧牲了,但是免疫力被削弱總比死于白血病要好得多(duō)。
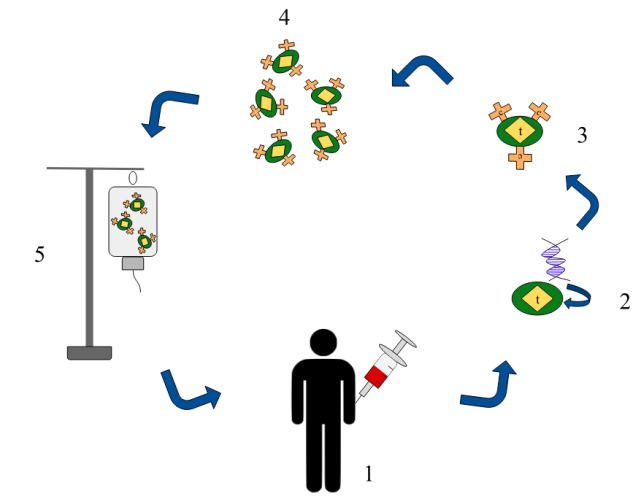
可(kě)以說,是T細胞和B細胞的發現讓免疫治療成為(wèi)可(kě)能(néng)。在維持免疫系統的衆多(duō)細胞中(zhōng),T細胞和B細胞是非常合适的利劍,因為(wèi)它們易于分(fēn)離和培養,能(néng)在體(tǐ)外大量增殖,并且作(zuò)為(wèi)獲得性免疫的一部分(fēn)在體(tǐ)内擁有(yǒu)非常強大的力量。
至于Max D. Cooper和Jacques Miller最終會不會獲得諾獎,我覺得已經根本不重要了,他(tā)們的名(míng)字将永遠(yuǎn)地被記錄在教科(kē)書上,接受世世代代生物(wù)醫(yī)學(xué)學(xué)生的頂禮膜拜。
參考資料:
1. https://www.chop.edu/stories/relapsed-leukemia-emilys-story
2. CD19-targeted chimeric antigen receptor T-cell therapy for acute lymphoblastic leukemia.Shannon L. Maude et al, Blood Jun 2015, 125 (26) 4017-4023
3. Alexander D. Gitlin& Michel C. Nussenzweig, Immunology: Fifty years of B lymphocytes, Nature 517, 139–141 (08 January 2015)
4. Geoff Watts, Jacques Miller: immunologist who discovered role of the thymus, The Lancet VOLUME 378, ISSUE 9799, P1290, OCTOBER 08, 2011
複制本文(wén)鏈接 文(wén)章為(wèi)作(zuò)者獨立觀點不代表本網站立場,未經允許不得轉載。

 京公(gōng)網安(ān)備
11010802036058号
京公(gōng)網安(ān)備
11010802036058号
評論