細胞療法是目前臨床前和臨床環境中(zhōng)研究最多(duō)的治療方式之一,許多(duō)細胞治療産(chǎn)品已獲得批準。截止2022年初,全球經批準的細胞治療産(chǎn)品共33款,包括12種免疫細胞和21種幹細胞。值得注意的是,許多(duō)已經批準的細胞療法正在開發新(xīn)的适應症。
下文(wén),我們将分(fēn)别介紹已經獲得各國(guó)監管機構批準上市的細胞治療産(chǎn)品。
-01-
全球臨床批準的細胞産(chǎn)品
免疫細胞,目前隻有(yǒu)T細胞和DC産(chǎn)品被批準上市。其中(zhōng)大多(duō)數 T 細胞産(chǎn)品是用(yòng)于血液系統惡性腫瘤的CAR-T療法,而 DC 産(chǎn)品是用(yòng)于治療實體(tǐ)腫瘤的疫苗。
臨床批準的免疫細胞産(chǎn)品
目前,全球範圍内共批準了9種T細胞相關産(chǎn)品,其中(zhōng)美國(guó)FDA批準上市6 款CAR-T 産(chǎn)品,中(zhōng)國(guó)NMPA批準上市2款CAR-T産(chǎn)品。有(yǒu)意思的是,韓國(guó)KFDA批準上市1款CIK産(chǎn)品。
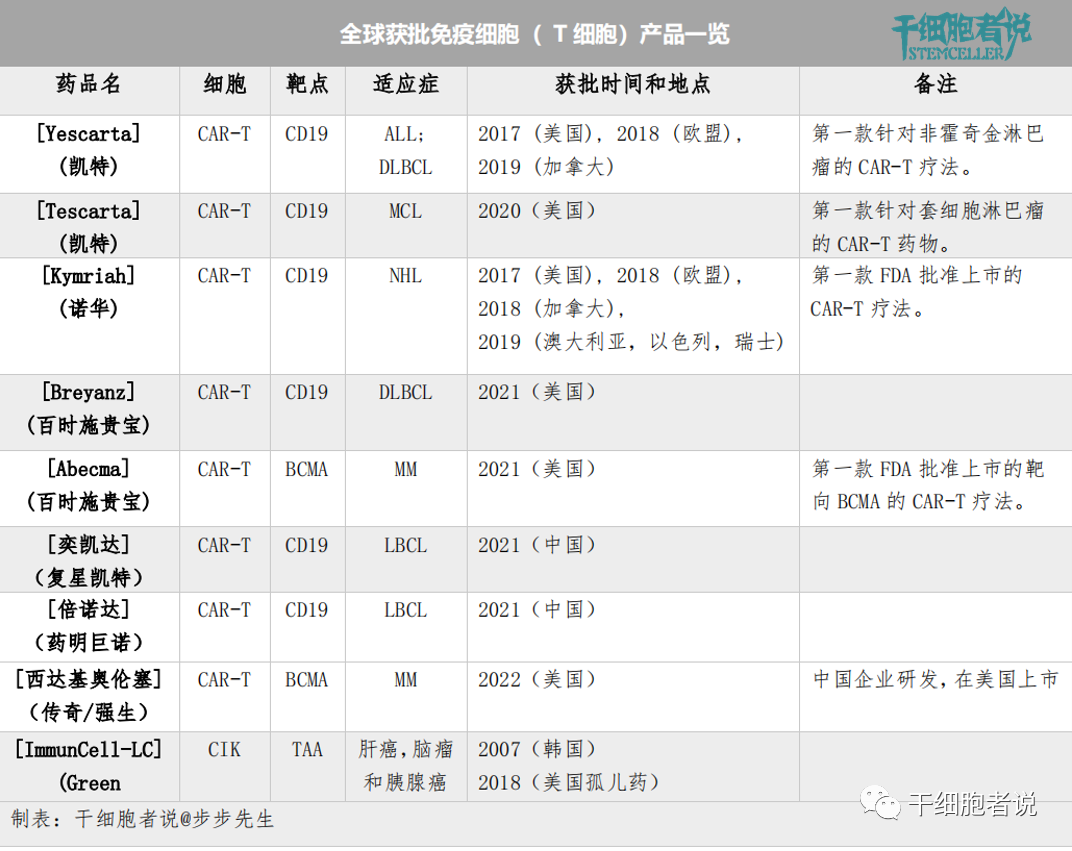
各國(guó)獲批免疫細胞( T 細胞)一覽
CAR的兩個基本部分(fēn)包括用(yòng)于識别癌細胞表面抗原的細胞外靶點結合域和細胞内信号部分(fēn),由共同刺激和激活域組成,啓動包括激活、擴增和細胞殺傷在内的過程。值得注意的是,所有(yǒu)經批準的CAR-T産(chǎn)品都是自體(tǐ)的,并且含有(yǒu)靶向CD19的CAR(CD19是B細胞表面标記物(wù))。
目前全球市場上共有(yǒu)8種CAR-T産(chǎn)品獲上市批準。2017年,美國(guó)FDA批準全球第一款CAR-T細胞療法Kymriah。Kymriah适用(yòng)于複發性、難治型以及青少年B細胞急性淋巴性白血病(ALL) ,主要用(yòng)于青少年、兒童患者。
2020年,第三款CAR-T産(chǎn)品Tecartus獲得美國(guó)FDA批準。Tecartus适用(yòng)于治療成人r/r套細胞淋巴瘤(MCL),這是一種侵襲性、罕見的非霍奇金淋巴瘤。Tecartus制備過程包括一個豐富T細胞群的步驟,并從患者外周血單個核細胞(PBMC)中(zhōng)去除循環腫瘤細胞(CTC)。目的是防止CAR-T細胞在體(tǐ)外制備過程中(zhōng)活化和随後耗盡。
目前全球市場上隻有(yǒu)1種CIK産(chǎn)品獲上市批準。ImmunCell-LC是一種自體(tǐ)細胞因子誘導殺傷 (CIK)細胞療法,在2007 年獲得韓國(guó)KFDA 批準,并在2018年獲得美國(guó)FDA孤兒藥稱号。它被用(yòng)作(zuò)肝細胞癌、腦腫瘤和胰腺癌切除後的輔助治療,通過清除殘餘腫瘤細胞實現治療。ImmunCell-LC的制備,通過分(fēn)離外周血單個核細胞(PBMC),然後用(yòng)IL-2和抗CD3抗體(tǐ)一起刺激培養,最後得到活化的混合的一群異質(zhì)性T細胞。
3. DC細胞
目前全球市場上共有(yǒu)3種DC産(chǎn)品獲上市批準。DC 疫苗是免疫細胞治療另一個活躍領域,主要采用(yòng)自體(tǐ)細胞。
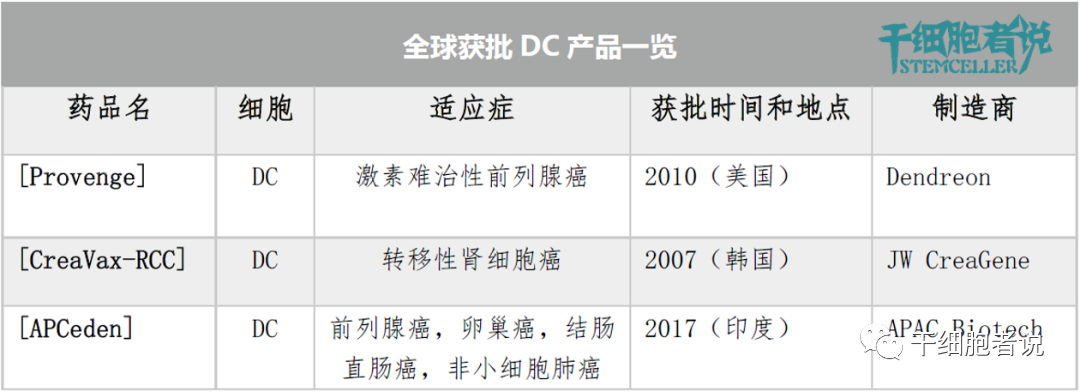
各國(guó)獲批DC産(chǎn)品一覽
2010年,Provenge獲得美國(guó)FDA批準,用(yòng)于治療激素難治性前列腺癌。Provenge是美國(guó)FDA批準的第一個DC療法,也是FDA批準的唯一的DC療法。
Provenge制備:
收集患者的外周血單個核細胞(PBMC),然後用(yòng)前列腺特異性癌相關抗原(PAP)和GM-CSF進行體(tǐ)外擴增獲得。
Provenge療程:
Provenge是由DC為(wèi)主的多(duō)細胞懸浮液,分(fēn)3次靜脈注射,每次間隔2周。
Provenge作(zuò)用(yòng)機制:
作(zuò)用(yòng)機制是DC介導的PAP向患者T細胞呈遞,引發針對前列腺癌細胞的适應性免疫反應。
2007年,自體(tǐ)DC療法CreaVax被韓國(guó)KFDA批準,用(yòng)于腎細胞癌的治療。2017年,自體(tǐ)DC療法APCeden被印度CDSCO批準,用(yòng)于治療前列腺癌、卵巢癌、結直腸癌和非小(xiǎo)細胞肺癌等疾病的治療。
臨床批準的幹細胞産(chǎn)品
截至目前,全球共有(yǒu)21種幹細胞産(chǎn)品已在全球獲得批準,其中(zhōng)12種獲得美國(guó)FDA或歐洲EMA的批準。其餘9種産(chǎn)品主要在亞洲獲得批準。值得注意的是,獲批産(chǎn)品主要是由造血幹細胞或間充質(zhì)幹細胞組成。另外,還有(yǒu)一個角膜緣幹細胞産(chǎn)品。
1. 造血幹細胞(HSC)
目前全球批準的造血幹細胞療法共有(yǒu) 10 種。其中(zhōng)美國(guó)FDA批準 8 種臍血産(chǎn)品,均用(yòng)于造血幹細胞移植的治療。歐盟EMA 批準 2 種基于自體(tǐ)造血幹細胞的基因療法,Strimvelis 用(yòng)于腺苷脫氨酶缺乏症(ADA-SCID),Zynteglo 用(yòng)于治療輸血依賴性地中(zhōng)海貧血症。
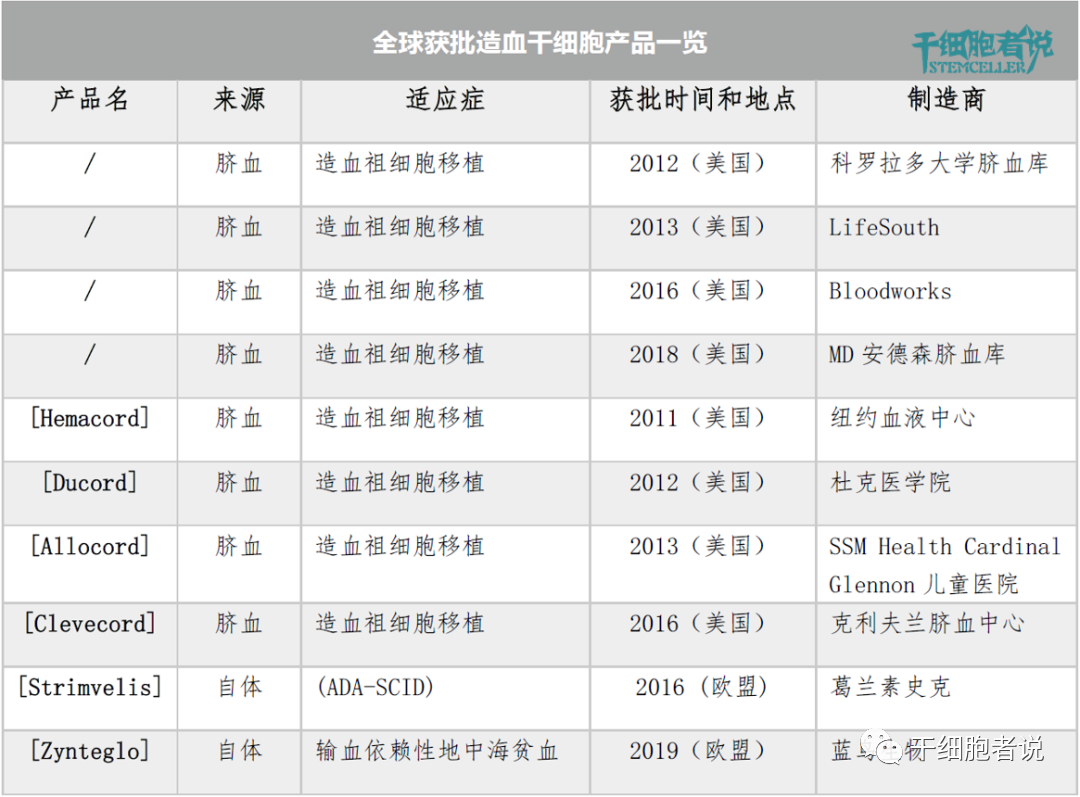
各國(guó)獲批造血幹細胞産(chǎn)品一覽
臍血造血幹細胞比其他(tā)來源(如骨髓,外周血)的異體(tǐ)造血幹細胞更有(yǒu)優勢。因為(wèi)臍血獲得更容易,對人類白細胞抗原(HLA)的耐受性更高錯配,GVHD的風險較低。
此外,Strimvelis和Zynteglo均是EMA批準的基于自體(tǐ)造血幹細胞的基因療法。
2016年,EMA批準Strimveli,适用(yòng)于腺苷脫氨酶缺乏症(ADA-SCID),一種由腺苷脫氨酶(ADA)基因編碼突變引起的免疫缺陷疾病。
2019年,EMA批準Zyntegl, 适用(yòng)于治療輸血依賴性地中(zhōng)海貧血,這是一種由β-珠蛋白基因突變引起的遺傳性疾病,導緻成人血紅蛋白顯著減少或缺失。
2. 間充質(zhì)幹細胞(MSCs)
目前全球批準的間充質(zhì)幹細胞産(chǎn)品共有(yǒu) 10 種,但沒有(yǒu)一款獲得美國(guó)FDA 的批準。根據作(zuò)用(yòng)機制和批準的适應症,MSCs産(chǎn)品可(kě)分(fēn)為(wèi)兩大類:組織修複和免疫調節。
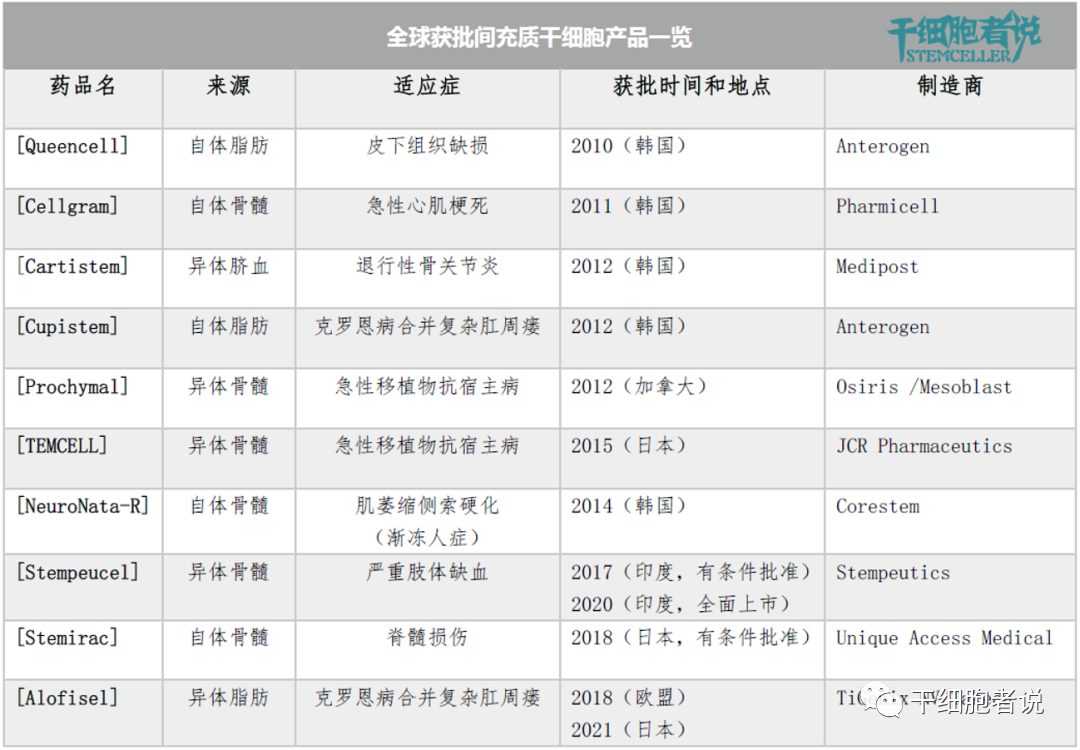
各國(guó)獲批間充質(zhì)幹細胞産(chǎn)品一覽
其中(zhōng),有(yǒu)三種MSCs産(chǎn)品已被批準用(yòng)于組織修複應用(yòng)。
2011年,韓國(guó)KFDA批準基于MSCs的組織修複産(chǎn)品Cellgram, 适用(yòng)于治療急性心肌梗死。
2012年,韓國(guó)KFDA批準另一種基于MSCs的組織修複産(chǎn)品Cartistem,适用(yòng)于重複性和/或創傷性軟骨退行性病變,包括退行性骨關節炎。
2010年,韓國(guó)KFDA批準一種自體(tǐ)脂肪來源的細胞産(chǎn)品Queencell,适用(yòng)于皮下組織缺損的治療。不過,Queencell并非由單一MSCs組成,而是由MSCs、周細胞、肥大細胞、成纖維細胞和内皮祖細胞的混合細胞組成,類似于SVF。
MSCs具(jù)有(yǒu)免疫調節功能(néng),可(kě)用(yòng)于調節多(duō)種疾病的免疫反應。其中(zhōng),七種MSCs産(chǎn)品已被批準,适應症包括克羅恩病(Alofisel、Cupistem)、急性移植物(wù)抗宿主病(Prochymal、TEMCELL)、肌萎縮側索硬化(NeuroNata-R)、脊髓損傷(Stemirac)和Buerger病引起的嚴重肢體(tǐ)缺血(Stempeucel)。
Alofisel,一種異體(tǐ)脂肪來源MSCs産(chǎn)品。EMA批準的唯一MSCs産(chǎn)品,适應症是克羅恩病複雜肛周瘘。作(zuò)用(yòng)機制主要是MSCs抑制活化淋巴細胞增殖從而減少促炎細胞因子産(chǎn)生。
Cupistem,一種自體(tǐ)脂肪來源MSCs産(chǎn)品。2012年獲得韓國(guó)KFDA批準,适應症是克羅恩病複雜肛周瘘。
Prochymal,一種異體(tǐ)骨髓來源MSCs産(chǎn)品。2012年獲得加拿(ná)大CFIA批準,适應症是兒童類固醇難治性急性GVHD。
值得注意的是,在3期臨床試驗中(zhōng),Prochymal在SR-aGvHD兒童患者首次類固醇治療失敗後使用(yòng),顯示了作(zuò)為(wèi)一線(xiàn)治療的安(ān)全性、耐受性和有(yǒu)效性。然而,FDA拒絕批準,FDA給出的理(lǐ)由是試驗數據來自單臂試驗而不是随機試驗,建議至少再做一次随機試驗的數據。
其中(zhōng)一些MSCs産(chǎn)品(例如Cellgram, Cartistem、Prochymal)正在當前臨床試驗中(zhōng)評估其他(tā)适應症,包括酒精(jīng)性肝硬化、COVID-19引起的急性呼吸窘迫綜合征(ARDS)和軟骨損傷。
除了已經批準的造血幹細胞和MSCs産(chǎn)品外,還有(yǒu)1款角膜緣幹細胞(LSC)産(chǎn)品也獲批。2015年,歐盟EMA批準Holoclar,用(yòng)于治療眼部燒傷引起的角膜幹細胞缺乏症。但是,由于Holoclar以角膜片而非單細胞懸浮液的給藥方式,我們暫時不讨論。
其他(tā)細胞療法
1. 紅細胞和血小(xiǎo)闆
血液制品在治療血液疾病和缺陷方面有(yǒu)着悠久的曆史,但目前并沒有(yǒu)針對紅細胞和血小(xiǎo)闆的特定經批準的産(chǎn)品。
紅細胞療法适用(yòng)于治療因血液疾病(即地中(zhōng)海貧血、鐮狀細胞病、鐵或其他(tā)維生素缺乏、再生障礙性貧血)而引起的貧血症。靜脈注射前,血液必須進行ABO血型和RhD匹配。最常用(yòng)的是紅細胞輸注,但也可(kě)以輸注全血。
血小(xiǎo)闆輸注用(yòng)于治療血栓血細胞減少症(疾病或癌症治療引起)。血小(xiǎo)闆的最佳儲存條件和給藥方案是目前研究的方向。
2. 微生物(wù)療法
目前,國(guó)際上并沒有(yǒu)批準任何一種臨床使用(yòng)的微生物(wù)藥物(wù),但臨床上使用(yòng)相關的療法。第一種是糞便菌群移植(FMT),其中(zhōng)健康捐贈者的糞便溶液被供應到患者的腸道,以改變腸道微生物(wù)組組成。雖然可(kě)用(yòng)于臨床治療,但并沒有(yǒu)作(zuò)為(wèi)藥品開發的。第二種是益生菌,包括在非處方藥中(zhōng)廣泛使用(yòng)的活菌群,也可(kě)由臨床醫(yī)生處方。通常被歸類為(wèi)食品、功能(néng)性食品或補充劑,因此也不作(zuò)為(wèi)藥物(wù)監管處理(lǐ)。
-02-
小(xiǎo)結與問題
最後回顧一下,全球經批準細胞治療産(chǎn)品共有(yǒu)的33款,包括12種免疫細胞(CAR-T細胞8種,DC細胞3種,CIK細胞1種)和21種幹細胞(臍血造血幹細胞10種,間充質(zhì)幹細胞10種,角膜緣幹細胞1種)。值得一提的是,紅細胞和血小(xiǎo)闆,還有(yǒu)微生物(wù)療法,雖然可(kě)用(yòng)于臨床治療,但并沒有(yǒu)一款作(zuò)為(wèi)藥品開發和監管的。
總體(tǐ)來看,幹細胞治療正如雨後春筍般興起,為(wèi)諸多(duō)難治性疾病提供了一條有(yǒu)效治療途徑。從早期對細胞療法的質(zhì)疑,到現在似乎又(yòu)重新(xīn)變成一個充滿活力的新(xīn)興行業。
目前,中(zhōng)國(guó)對細胞治療分(fēn)别按藥品注冊和醫(yī)療技(jì )術進行“類雙軌制”監管。按藥品注冊開展臨床試驗,由國(guó)家藥品監督管理(lǐ)局(NMPA)監管,最終可(kě)上市銷售;按醫(yī)療技(jì )術開展臨床研究,由衛健委監管,最終經備案通過後進行臨床研究獲得試驗數據,但目前尚未有(yǒu)明确的臨床轉化途徑(即收費)。
參考文(wén)獻
Wang LL, Anselmo AC, Mitragotri S, etc. Cell therapies in the clinic. Bioeng Transl Med. 2021
複制本文(wén)鏈接 文(wén)章為(wèi)作(zuò)者獨立觀點不代表本網站立場,未經允許不得轉載。

 京公(gōng)網安(ān)備
11010802036058号
京公(gōng)網安(ān)備
11010802036058号
評論