細胞遷移,與細胞移動同義,與細胞運動義近,指的是細胞在接收到遷移信号或感受到某些物(wù)質(zhì)的濃度梯度後而産(chǎn)生的移動。移動過程中(zhōng),細胞不斷重複着向前方伸出突觸/僞足,然後牽拉後方胞體(tǐ)的循環過程。細胞骨架和其結合蛋白,還有(yǒu)細胞間質(zhì)是這個過程的物(wù)質(zhì)基礎,另外還有(yǒu)多(duō)種物(wù)質(zhì)會對之進行精(jīng)密調節。
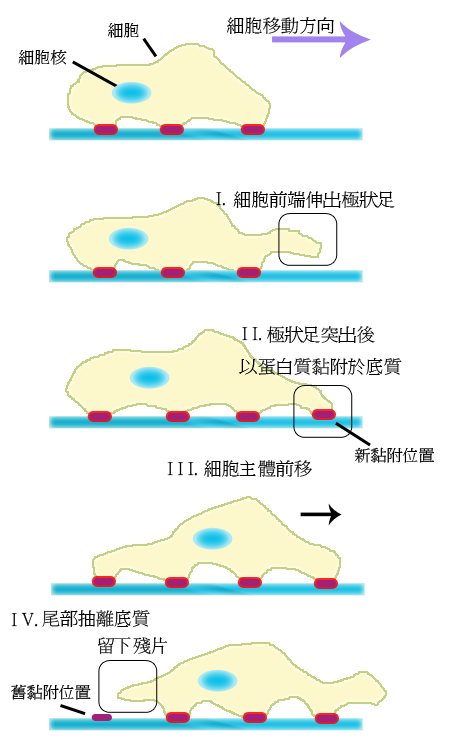
細胞遷移過程的四個步驟
若以移動方式與型态來比較,細胞遷移是通過胞體(tǐ)形變進行的定向移動,這有(yǒu)别于其他(tā);如細胞靠鞭毛與纖毛的運動、或是細胞随血流而發生的位置變化,而且就移動速度來看,相比起後兩者,細胞遷移要慢得多(duō)。舉例而言:成纖維細胞[注 ]的移動速度為(wèi)微米每分(fēn),若以精(jīng)子的平均遊動速度.微米/每秒(miǎo),即微米/每分(fēn)來比較,兩者差距約倍以上。角膜細胞即使比成纖維細胞快上十倍,但是要完成從不來梅到漢堡這公(gōng)裏的路程仍需要年[注 ]。而且細胞用(yòng)力甚輕。成纖維細胞胞體(tǐ)收縮的力隻有(yǒu)×−牛頓,而角膜細胞的則是×−牛頓(一牛頓約為(wèi)人用(yòng)手舉起一雞蛋所用(yòng)的力道)。
但此等“步緩力微”的細胞遷移,卻是細胞覓食、傷口痊愈、胚胎發生、免疫反應、感染和癌症轉移等等生理(lǐ)現象所涉及到的。因此細胞遷移是目前細胞生物(wù)學(xué)研究的一個主要課題,科(kē)學(xué)家們試圖通過對細胞遷移的研究,在阻止癌症轉移、異體(tǐ)植皮等醫(yī)學(xué)應用(yòng)方面取得更大成果。也因為(wèi)細胞遷移獨有(yǒu)的運動特性,成為(wèi)今生物(wù)學(xué)熱門研究方向。
細胞遷移的研究史
年,顯微技(jì )術的先驅人物(wù)安(ān)東尼·凡·列文(wén)虎克往英國(guó)皇家學(xué)會寄出一封信,裏面描寫了細菌的運動。這封信可(kě)以說是打開了科(kē)學(xué)家對細胞遷移研究的第一頁(yè)。在往後這多(duō)年時間,人們就一直試圖去理(lǐ)解細胞遷移過程的細節。
而細胞遷移的關鍵物(wù)質(zhì)—細胞骨架則要等到世紀才被發現。雖然年科(kē)學(xué)家阿爾伯特·山(shān)特吉爾吉就已發現細胞骨架的成分(fēn)—肌動蛋白和肌球蛋白,但是因為(wèi)電(diàn)子顯微鏡制作(zuò)樣本時需要對樣品進行到 °C的低溫固定,在這樣的溫度下細胞骨架會被破壞,即所謂的“解聚”。所以當時認為(wèi)細胞質(zhì)不過是一“蛋白湯”,各種細胞器懸浮于細胞質(zhì)液(Cytosol)中(zhōng)。但在年代後,人們使用(yòng)戊二醛常溫固定的方法開始逐漸發現細胞骨架。科(kē)學(xué)家發現,細胞骨架在細胞遷移的過程中(zhōng)起到承載和支撐的作(zuò)用(yòng)。在世紀末世紀初,科(kē)學(xué)家對細胞遷移複雜機理(lǐ)的認識有(yǒu)了非常大的進步,對細胞與基質(zhì)的粘着,非對稱性極化和胞内分(fēn)層運動都有(yǒu)了進一步的了解。但是整個過程其實仍未被了解透徹,很(hěn)多(duō)中(zhōng)間過程就是連起作(zuò)用(yòng)的物(wù)質(zhì)都未明。科(kē)學(xué)家對其中(zhōng)部分(fēn)需要進行假設,再進一步通過實驗去證實。
研究技(jì )術
為(wèi)了研究某一蛋白質(zhì)在細胞遷移中(zhōng)所扮演的角色,一般來說科(kē)學(xué)家可(kě)以将某蛋白的編碼基因進行突變,甚至應用(yòng)新(xīn)近的RNAi現象,或者加入該蛋白質(zhì)的阻斷劑(inhibitor)來抑制某一個蛋白質(zhì)的表現,并分(fēn)析此抑制對于細胞遷移的影響,反而得知被抑制的蛋白質(zhì)與細胞遷移的作(zuò)用(yòng)。
新(xīn)科(kē)技(jì )對細胞遷移研究起到了極大的推動作(zuò)用(yòng)。科(kē)學(xué)家通過ECIS技(jì )術(Electric Cell-substrate Impedance Sensing;電(diàn)子細胞基質(zhì)阻抗判斷)可(kě)以觀察到細胞在傳統細胞培養甚至是液體(tǐ)環境中(zhōng)的移動行為(wèi)。根據ECIS技(jì )術觀測細胞電(diàn)學(xué)參數的能(néng)力,ECIS技(jì )術還可(kě)以量化測量腫瘤細胞遷移過程中(zhōng)細胞層形态變化。同樣是在腫瘤研究領域,ATIM(Fluorescence- Assisted Transmigration Invasion and Motility Assay,熒光協助轉移侵入和運動分(fēn)析法) 提供了快速定量細胞侵入(細胞從一個區(qū)域進入另一區(qū)域)的更好方法,允許檢測大量樣品和不同條件下時間依賴性侵入。更重要的是,這一系統可(kě)以方便地通過在多(duō)孔膜上增加胞外基質(zhì)的厚度來監測細胞侵入結構的深度。韓國(guó)延世大學(xué)的樸宗哲和樸峰珠則發展出一套細胞跟蹤系統。它是由計算機輔助的時間流逝顯示微觀複制系統,其中(zhōng)有(yǒu)影象形成過程軟件,其程序編制含有(yǒu)自動影象分(fēn)析和自設計CO微小(xiǎo)細胞培育器,它的功能(néng)是在一個倒置顯微鏡平台上,對于細胞遷移進行迅速而精(jīng)确的分(fēn)析,從而形成對于細胞的培育。目前已知他(tā)們運用(yòng)這一計算機輔助系統計算了外細胞間質(zhì)(ECMs)覆蓋表面的細胞遷移過程。
斑馬魚是目前在該領域最常用(yòng)于研究的生物(wù)。細胞遷移是脊椎動物(wù)胚胎發育的核心過程之一。細胞從原分(fēn)裂生成的部位移動到目的部位就是細胞的遷移。斑馬魚有(yǒu)着很(hěn)大的優勢,首先是其胚胎能(néng)在母體(tǐ)外發育,速度快,受精(jīng)小(xiǎo)時後身體(tǐ)的器官已大部分(fēn)就位。而且斑馬魚繁殖量大,容易對之進行變異。還有(yǒu)其胚胎透明,在高分(fēn)辨率快進攝影技(jì )術的幫助下,人們可(kě)以很(hěn)好的觀察到細胞遷移的過程,還可(kě)以利用(yòng)綠色熒光蛋白(GFP)可(kě)以觀察到細胞在斑馬魚體(tǐ)内的分(fēn)布情況。
參與細胞遷移的分(fēn)子
細胞遷移需要内外因素的配合。外部的因素指的是細胞外的信号分(fēn)子。内部因素則指細胞的信号傳導系統和執行運動的細胞骨架和分(fēn)子馬達,還有(yǒu)參與粘着斑形成的各種分(fēn)子(關于參與形成粘着斑的各種分(fēn)子請見突出與底質(zhì)的粘着)。細胞外信号結合胞膜受體(tǐ)完成其使命後,需要細胞内信号分(fēn)子接力,将運動信息進一步傳給細胞遷移的執行單位——細胞骨架和分(fēn)子馬達。種類繁多(duō)的細胞内信号分(fēn)子會相互作(zuò)用(yòng),影響後述這兩種分(fēn)子的分(fēn)布,結構和活性,達到精(jīng)細調整細胞運動的目的。
細胞遷移有(yǒu)關的生理(lǐ)過程
細胞遷移是多(duō)種生理(lǐ)過程的前提,例如創傷恢複,神經嵴細胞的移行,急性炎症中(zhōng)白細胞的滲出還有(yǒu)癌細胞的轉移。
胚胎發生
高等動植物(wù)成體(tǐ)的結構非常複雜,但都是來自于一個受精(jīng)卵。受精(jīng)卵不斷分(fēn)裂,所得出的細胞會移動,還會通過基因的開啓或關閉進入分(fēn)化途徑,形成特異的細胞,執行其被指定的功能(néng)。胚胎發生(Embryogenesis)通常被分(fēn)為(wèi)三個階段。第一階段是原腸胚形成,指受精(jīng)卵分(fēn)裂到囊胚後,經過囊胚的折疊逐漸成為(wèi)有(yǒu)三層胚層結構的原腸胚的整個過程,此過程後身體(tǐ)各部分(fēn)的構造方向已基本定下。第二階段是器官形成(Organogenesis)。最後階段則是各器官繼續成熟完善至成體(tǐ)狀态。
動物(wù)的胚胎發生涉及大量的細胞遷移行為(wèi)。科(kē)學(xué)家在研究這些細胞遷移時,可(kě)以使用(yòng)無毒性的染料,或者是可(kě)以遺傳的遺傳學(xué)标簽(heritable genetic label)對那些将要遷移的細胞進行标示,以追蹤其動向。例如,科(kē)學(xué)家可(kě)以從鹌鹑胚胎内取出其将來要成為(wèi)翅膀的體(tǐ)節(Somite),将該體(tǐ)節移植入培養了兩天的小(xiǎo)雞胚胎中(zhōng)。經過一周後,将小(xiǎo)雞翅膀部分(fēn)剖開并觀察其肌肉,可(kě)見它們是來自鹌鹑體(tǐ)節的。
觀察無脊椎動物(wù)如海膽(sea urchin)的原腸胚形成過程(Gastrulation),即從囊胚(Blastula)到原腸胚(Gastrula)的形成過程。開始時囊胚是由約1000個細胞組成的,球狀中(zhōng)空結構,球腔即為(wèi)囊胚腔(blastocoele),球壁由單層細胞組成,植物(wù)極(Vegetal pole,可(kě)以看作(zuò)是日後海膽身體(tǐ)的尾部)上皮比較厚,出現細胞内餡的傾向。然後一些間充質(zhì)細胞開始遊離植物(wù)極上皮,并在囊胚腔内爬行。而植物(wù)極上皮也開始向内折疊,上皮外圍的細胞會向囊胚腔伸出絲狀僞足,幫助上皮向動物(wù)極(可(kě)以看作(zuò)為(wèi)海膽日後的頭部)移動并最終與囊胚腔另一端接合。上皮内陷折疊時,留下的空隙會成為(wèi)日後的腸道,上皮與囊胚壁接觸之處則是日後海膽的口部。
脊椎動物(wù)的神經嵴細胞,在胚胎期會不斷從背側向腹側移行。其中(zhōng)一部分(fēn)移行于外胚層下方,将來會分(fēn)化為(wèi)色素細胞,而那些行走的稍深一點的細胞,會形成後來交感神經的神經節細胞,腎上腺髓質(zhì)。而頸部和骶部的神經嵴細胞則會沿着身體(tǐ)縱軸移到腸壁。就是說,日後的組織腸神經叢,神經節神經元,腎上腺的嗜鉻細胞(chromaffin)都是由神經嵴細胞遷移分(fēn)化得出的。
值得注意的是,在此過程中(zhōng),沿途的不遷移細胞可(kě)能(néng)會影響遷移細胞的行為(wèi),改變它們的去向,甚至決定遷移細胞是否能(néng)存活。同來自神經嵴的性細胞,血細胞前體(tǐ)和色素細胞都受到一種Kit—Steel因子機制的調節。Kit是一種跨膜受體(tǐ),其配體(tǐ)是Steel因子。沿途的細胞或者是終點處的細胞會表達Steel因子,激活遷移經過的細胞上的Kit受體(tǐ)。而Kit受體(tǐ)的激活是這些細胞存活和增殖的前提。在一個個體(tǐ)中(zhōng),兩者之中(zhōng)的任一者出現突變,患者的體(tǐ)色,血細胞供應和性細胞的形成都會出現異常,例如患者額頭可(kě)見一白斑。
損傷修複
損傷會對機體(tǐ)造成身體(tǐ)部分(fēn)細胞和組織的喪失,機體(tǐ)需要對損傷進行修複(repair)。修複有(yǒu)兩種不同的形式,再生和纖維性修複。這兩個過程都涉及細胞遷移。例如上皮組織中(zhōng)的一種——鱗狀上皮如果出現缺損,其邊緣和底部的細胞就會分(fēn)裂增生,并向缺損中(zhōng)心遷移。雖然很(hěn)多(duō)種類的細胞都具(jù)有(yǒu)分(fēn)裂再生的能(néng)力,如上皮細胞,但是它們最終能(néng)否成功修複受損組織卻要依賴于細胞外基質(zhì)。例如細胞外基質(zhì)的一種成分(fēn)—透明質(zhì)酸(hyaluronan),存在于遷移細胞的周圍,它能(néng)夠抑制細胞間的粘附,促進細胞遷移。
如果損傷伴有(yǒu)炎症的發生,實質(zhì)細胞即使具(jù)有(yǒu)再生能(néng)力,也很(hěn)難獨自完成修複工(gōng)作(zuò)。這時就要靠肉芽組織(granulation tissue)進行修複了。肉芽組織會首先增生,并溶解吸收壞死組織和異物(wù),填補空缺,再最終轉化為(wèi)瘢痕組織完成修複。肉芽組織由新(xīn)生的毛細血管和成纖維細胞組成。血管内皮細胞會先遷移到受損部位新(xīn)生形成血管。接着血小(xiǎo)闆,炎細胞以及活化了的血管内皮細胞會釋放生長(cháng)因子,如TGF-β,DGF,表皮生長(cháng)因子,FGF和促纖維化性細胞因子如IL-1和TNF-α等分(fēn)子,這些因子能(néng)吸引單核巨噬細胞和成纖維細胞的增殖和遷移。前者會在受損部位清理(lǐ)細胞外碎片,纖維蛋白和其他(tā)外源物(wù)質(zhì)。而成纖維細胞則會合成細胞外基質(zhì)并不斷積聚。最後經過肉芽組織的結構調整,最終形成瘢痕。
細菌感染
緻病源微生物(wù)對宿主細胞的入侵同樣會造成微絲的動态改變。很(hěn)多(duō)緻病細菌經過演化,甚至是和宿主共同演化(coevolution),發展出一套生存策略,利用(yòng)宿主細胞動力蛋白的多(duō)聚化,為(wèi)自身的入侵,繁殖或擴布創造條件。而通過研究這些細菌對細胞骨架的作(zuò)用(yòng)途徑,科(kē)學(xué)家可(kě)以對細胞遷移的調控作(zuò)更深入的了解。
1994年研究人員發現,分(fēn)布在細胞外或是存在吞噬泡(Phagosome)内的格蘭氏陰性細菌,如志(zhì)賀氏菌(Shigella)和沙門菌(Salmonella),演化出一套III型分(fēn)泌系統(Type III Secretion System,簡稱TTSS),可(kě)以将細菌蛋白質(zhì)注射入真核細胞細胞質(zhì)内,模拟細胞内的細胞因子,控制腸上皮細胞或腸内皮細胞細胞骨架的重整理(lǐ)(Rearrangement),賦予這些不具(jù)備内吞能(néng)力的細胞以胞吞能(néng)力,以便自己進入細胞内,這種機制被稱為(wèi)觸發器機制(Trigger)。具(jù)體(tǐ)地說,沙門菌會分(fēn)泌蛋白質(zhì)SipC。SipC的N端會與肌動蛋白結合,C端具(jù)有(yǒu)促進肌動蛋白核化的功能(néng)。而志(zhì)賀氏菌有(yǒu)着與SipC同源的蛋白質(zhì)IpaC,則會激活Cdc42和Rac。這樣,肌動蛋白會在細菌與細胞結合處多(duō)聚化,為(wèi)細菌的進入創造條件。同時,志(zhì)賀氏菌還會分(fēn)泌IpaA,這種蛋白會結合細胞内的粘着斑蛋白(Vinculin,或譯鈕帶蛋白),并将後者帶到細菌與細胞接觸之處,形成粘着斑樣結構,被稱為(wèi)入侵焦點(Entry Focus)。這種IpaA-粘着斑蛋白能(néng)使所在之處的微絲解聚,使得志(zhì)賀氏菌更容易進入細胞。
另外還有(yǒu)拉鏈機制(Zipper)。細胞膜表面具(jù)有(yǒu)一系列受體(tǐ),它們是為(wèi)胞胞連合和胞底質(zhì)聯合所需的。一些細菌,如單核細胞增生李斯特氏菌(Listeria monocytogenes)和鼠疫杆菌(Yersinia)會在自己表面表達出這些受體(tǐ)的配體(tǐ),這樣可(kě)以誘使細胞伸出僞足包繞自身,并最終被吞入胞内。李斯特氏菌會表達一種名(míng)叫内化素A(Internalin A)的蛋白,它會結合胞胞連合蛋白質(zhì)E鈣粘蛋白(E cadherin)。而耶爾森氏菌則會使用(yòng)侵染素(Invasin)結合β-整合蛋白(β-Integrin)。目前人們認為(wèi),這兩種途徑會最終讓肌動蛋白-肌球蛋白組合産(chǎn)生拉力,将細菌拉入胞内。
白細胞滲出
炎症反應最重要的功能(néng)是将白細胞送到炎症竈,所以白細胞的滲出是炎症反應最重要的特征。其過程如下:炎症部位的血管内皮細胞會在組胺,白三烯等物(wù)質(zhì)作(zuò)用(yòng)下,加上骨架重構,穿胞作(zuò)用(yòng)的增強和損傷而收縮,随之而來的是血管通透性的增加,這進一步造成血流速度的減慢甚至是停滞。到達該處的白細胞因此會離開血管的中(zhōng)心部,邊集于血管壁,不斷滾動直至最後在胞膜表面選擇素(Selectin)的作(zuò)用(yòng)下與内皮細胞黏附。然後,白細胞會在内皮細胞連接處伸出僞足,以阿米巴運動的方式穿過間隙到達炎症竈,需時2到12分(fēn)鍾。而遊出的細胞也有(yǒu)分(fēn)先後,早期先是中(zhōng)性粒細胞遊出,48小(xiǎo)時之後再輪到單核細胞。遊出的白細胞然後會在炎症竈附近搜索細菌産(chǎn)物(wù),補體(tǐ)成分(fēn),細胞因子和白三烯。這些物(wù)質(zhì)能(néng)吸引甚至激活白細胞,将白細胞帶到炎症部位并發揮其吞噬,免疫和組織損傷作(zuò)用(yòng)。中(zhōng)性粒細胞和巨噬細胞能(néng)吞噬病原體(tǐ)或組織碎片,而巨噬細胞還會執行其抗原呈遞功能(néng),激活B,T淋巴細胞,以殺傷病原體(tǐ)。
癌症轉移
目前人們對惡性腫瘤的研究是多(duō)方面的,從癌症的産(chǎn)生到轉移,血管供給以及分(fēn)裂增殖都一直是醫(yī)學(xué)和生物(wù)學(xué)研究的熱點。癌症細胞增殖失控,短時間内可(kě)以繁殖出大量後代,這樣首先會造成生長(cháng)空間的局促和養分(fēn),如氧氣的緊張。這樣惡性腫瘤内會形成一片壞死區(qū),正如上面在組織損傷裏面提到的,機體(tǐ)會嘗試“修複”這些損傷。壞死組織會釋放出一系列促血管生成因子,如血管内皮生長(cháng)因子(vascular endothelial growth factor),還會招來巨噬細胞。巨噬細胞也會釋放大量促血管生成細胞因子和生長(cháng)因子。過程中(zhōng)有(yǒu)一類名(míng)叫高機動性組蛋白(high-mobility group proteins,簡稱HMGB)可(kě)能(néng)起到協調作(zuò)用(yòng)。最近研究表明其中(zhōng)的一種:HMGB1能(néng)強烈誘導血管内皮遷移。 新(xīn)生血管既解決了癌組織的供給問題,也為(wèi)癌細胞的遠(yuǎn)端轉移提供了管道。癌細胞借血道轉移到遠(yuǎn)端器官,并在那裏增殖。轉移是惡性腫瘤的确鑿證據,同時也是癌症患者的主要死亡原因。
癌細胞既能(néng)直接蔓延,如晚期子宮頸癌可(kě)直接蔓延至直腸和膀胱;它們又(yòu)可(kě)以對周遭組織進行浸潤,結果是形成邊界不分(fēn)明的癌組織,或是進入血管轉移到遠(yuǎn)端(見遠(yuǎn)端轉移)。兩者的機制比較複雜,目前還有(yǒu)未明的問題尚待解決。目前根據觀察可(kě)将癌症浸潤分(fēn)為(wèi)四步。首先癌細胞表面的粘附分(fēn)子會減少,與周圍的細胞彼此分(fēn)離,被“解除束縛”。同時癌細胞與基底膜的粘附卻會增加,這是癌細胞通過增加自身基底面層粘連蛋白(laminin)受體(tǐ)實現的。然後癌細胞會釋放蛋白酶,用(yòng)以降解細胞外基質(zhì)成分(fēn),如IV型膠原酶,使基底膜受損,産(chǎn)生縫隙。最後是癌細胞阿米巴運動樣的遷移,鑽過基底膜的縫隙,到達底下的間質(zhì)組織。癌細胞此後會繼續用(yòng)蛋白酶為(wèi)自己在間質(zhì)組織開路,直到血管,然後它會以同樣方式進入血管,經血到轉移後,又(yòu)以同樣方式出管。
癌症轉移過程中(zhōng)涉及的信号傳遞途徑,竟然有(yǒu)很(hěn)多(duō)是胚胎發育過程中(zhōng)所必需的。科(kē)學(xué)家在研究中(zhōng)發現越來越多(duō)重要的分(fēn)子,如N-鈣粘蛋白(N-Cadherin),核因子κB(NF-κB),骨連接素(Osteonectin),血栓素A2(Thromboxane A2)和Ras,都是促成癌細胞遷移的因子。
以ras基因(鼠肌小(xiǎo)節,Rat sarcoma)這個原癌基因為(wèi)例,其翻譯産(chǎn)物(wù)是一21達爾頓重的G蛋白Ras。Ras可(kě)分(fēn)為(wèi)四種經典Ras蛋白:H (Harvey)-Ras,N(Neuroblastoma,成神經細胞瘤)-Ras,和一對選擇性剪接産(chǎn)物(wù)K(Kirsten)-Ras4A和4B。從插圖2可(kě)見,Ras在信号傳導通路中(zhōng)位于中(zhōng)心位置,它的變異所造成的嚴重後果可(kě)想而知。人類30%的癌症中(zhōng)被查證有(yǒu)變異的ras基因,它們的産(chǎn)物(wù)一方面能(néng)抑制細胞凋亡,還會加快癌細胞轉移。H-Ras變異蛋白可(kě)見于膀胱癌和腎癌。而在幾乎所有(yǒu)的乳腺癌中(zhōng)都可(kě)看到變異的K-Ras。另外在肺癌,大腸癌和直腸癌中(zhōng)都可(kě)見其身影。K-Ras的作(zuò)用(yòng)很(hěn)可(kě)能(néng)是通過Ras-Raf-MEK-ERK途徑實現的。這條途徑不但能(néng)促進血管生成,還會誘發癌細胞的浸潤和轉移。
溶鞘磷脂,(Lysosphingomyelin,或稱鞘氨醇磷酰膽堿,英文(wén)Sphingosylphosphorylcholin),簡稱SPC,目前被懷疑是癌症轉移的啓動子。溶鞘磷脂是一種具(jù)有(yǒu)生物(wù)活性的胞内外信号傳導物(wù)質(zhì),能(néng)誘導細胞移行。它先是在患有(yǒu)A型尼曼匹克症(Niemann Pick type A)病人腦部被發現。它的受體(tǐ)是胞膜上的卵巢癌G蛋白偶聯受體(tǐ)1(Ovarian cancer G-Protein coupled receptor 1)。研究發現,患有(yǒu)卵巢癌的病人,其腹水中(zhōng)SPC水平明顯高于患良性卵巢腫瘤的患者。
在顯微鏡下通過觀察胰腺癌細胞在存在和不存在SPC情況下的活動和胞内角蛋白(Keratin)的分(fēn)布,可(kě)以大概了解SPC在癌症轉移中(zhōng)的作(zuò)用(yòng)。角蛋白屬于中(zhōng)間纖維,它的作(zuò)用(yòng)是維護細胞的穩定,賦予胞體(tǐ)一定的硬性。在未經SPC處理(lǐ)的胰腺癌細胞中(zhōng),角蛋白均勻分(fēn)布在細胞質(zhì)中(zhōng)。若它受到SPC的處理(lǐ),可(kě)以觀察到其角蛋白會被集中(zhōng)分(fēn)布到細胞核周圍,而細胞膜下角蛋白的濃度則會下降。角蛋白這樣的重新(xīn)分(fēn)布無疑使得癌細胞外圍變得更有(yǒu)柔韌性,讓它們更容易通過它們在基底膜打開的狹窄孔洞。
而在1996年被發現的RhoE則飾演着抑制癌症的角色。與其他(tā)遊移于激活/失活狀态的G蛋白不同,RhoE持續與GTP結合,一直處于激活狀态,所以其功能(néng)的上下調節靠的是其表達水平。在2007年一份研究報告中(zhōng)指出,RhoE在肺癌患者中(zhōng)表達異常,而且還與患者吸煙史有(yǒu)關。根據另一項研究,RhoE不僅在細胞增殖方面起到調節作(zuò)用(yòng),則在細胞遷移方面發揮着其功能(néng),甚至将某些癌細胞引向細胞凋亡。路德(dé)維希癌症研究所(Ludwig Institute for Cancer Research)的研究人員發現,RhoE會在生長(cháng)因子的刺激和DNA損壞的情況下表達增高,因此有(yǒu)可(kě)能(néng)成為(wèi)癌症的生物(wù)标記。RhoE能(néng)阻止肌動蛋白的聚合和應力纖維的形成,因此細胞遷移的能(néng)力會減弱。RhoE成為(wèi)癌症治療的又(yòu)一新(xīn)目标。
複制本文(wén)鏈接 文(wén)章為(wèi)作(zuò)者獨立觀點不代表本網站立場,未經允許不得轉載。

 京公(gōng)網安(ān)備
11010802036058号
京公(gōng)網安(ān)備
11010802036058号
評論