最近發布在《Stem Cells International》上發表了一篇題為(wèi):“The Clinical Trials of Mesenchymal Stromal Cells Therapy”的綜述。

文(wén)章内容主要闡述近年來全球間充質(zhì)幹細胞的臨床試驗成果。
簡介:一般而言,幹細胞是指具(jù)有(yǒu)增值、分(fēn)化和自我更新(xīn)能(néng)力的未分(fēn)化細胞群。關于效力,幹細胞屬于四種類型之一,包括單能(néng)細胞、專能(néng)細胞、多(duō)能(néng)細胞和全能(néng)細胞。
如果幹細胞保持自我更新(xīn)的能(néng)力并且隻能(néng)分(fēn)化成單個組織層的細胞類型,則它們被定義為(wèi)單能(néng)幹細胞。如果幹細胞在單個胚層内分(fēn)化成幾種不同的細胞類型,則它們被定義為(wèi)多(duō)能(néng)幹細胞。
如果它們從所有(yǒu)三個胚層分(fēn)化成細胞類型,即外胚層、中(zhōng)胚層、内胚層和功能(néng)配子,則稱為(wèi)多(duō)能(néng)幹細胞。全能(néng)幹細胞可(kě)以形成成人生物(wù)體(tǐ)和胚胎外組織的所有(yǒu)細胞類型 。
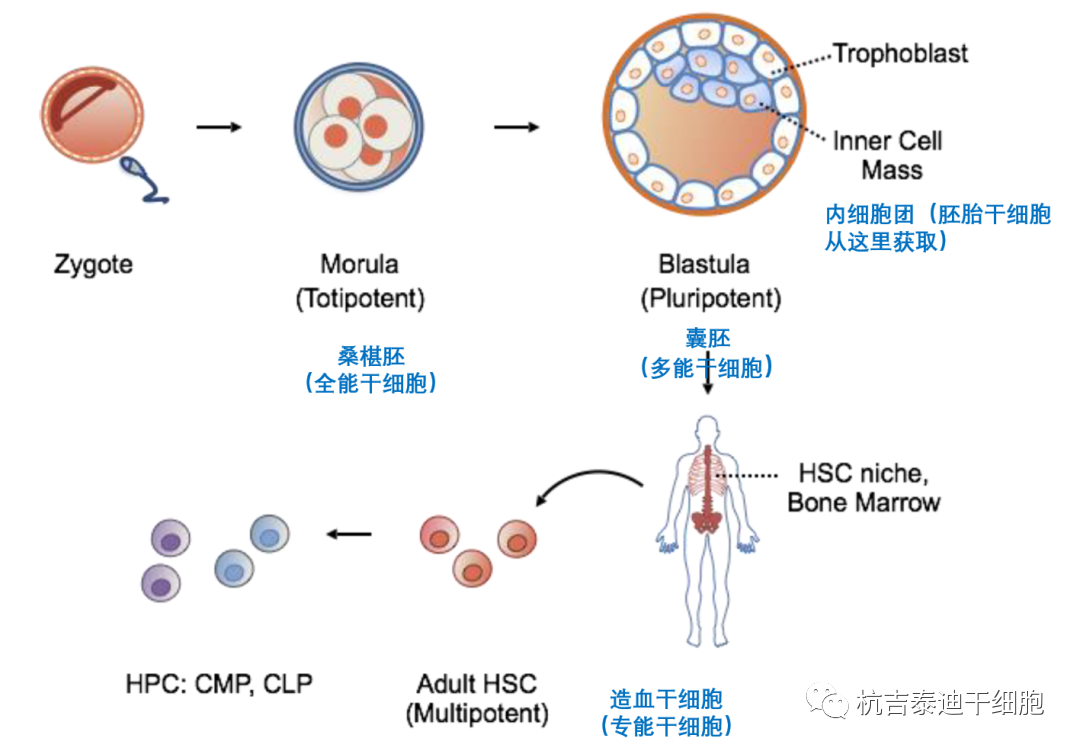
根據組織的來源,幹細胞也分(fēn)為(wèi)胚胎和成體(tǐ)。近年來引入了一種稱為(wèi)誘導多(duō)能(néng)幹細胞(iPSCs)的新(xīn)型幹細胞。胚胎幹細胞 (ESCs) 來源于植入前囊胚的内細胞團,被定義為(wèi)多(duō)能(néng)幹細胞。成體(tǐ)幹細胞存在于成體(tǐ)組織中(zhōng)并補充衰老細胞并随後再生受損組織。這些細胞,主要包括造血細胞、神經嵴衍生細胞和間充質(zhì)幹細胞 (MSCs),也被稱為(wèi)多(duō)能(néng)幹細胞。
如今,幹細胞治療不僅站在組織工(gōng)程和再生醫(yī)學(xué)的前沿,而且在基因和藥物(wù)傳遞系統等其他(tā)醫(yī)學(xué)領域也越來越發展。根據美國(guó)國(guó)家醫(yī)學(xué)圖書館 ( https://clinicaltrials.gov )),截至2021年5月18日,全球共有(yǒu)6205項幹細胞治療臨床試驗注冊。其中(zhōng),1240個與MSC治療有(yǒu)關。
如上所述,近年來科(kē)學(xué)家對基于MSC的治療的興趣有(yǒu)所增加。因此,目前的綜述論文(wén)旨在描述MSCs的特征以及基于MSC的治療的最新(xīn)進展。
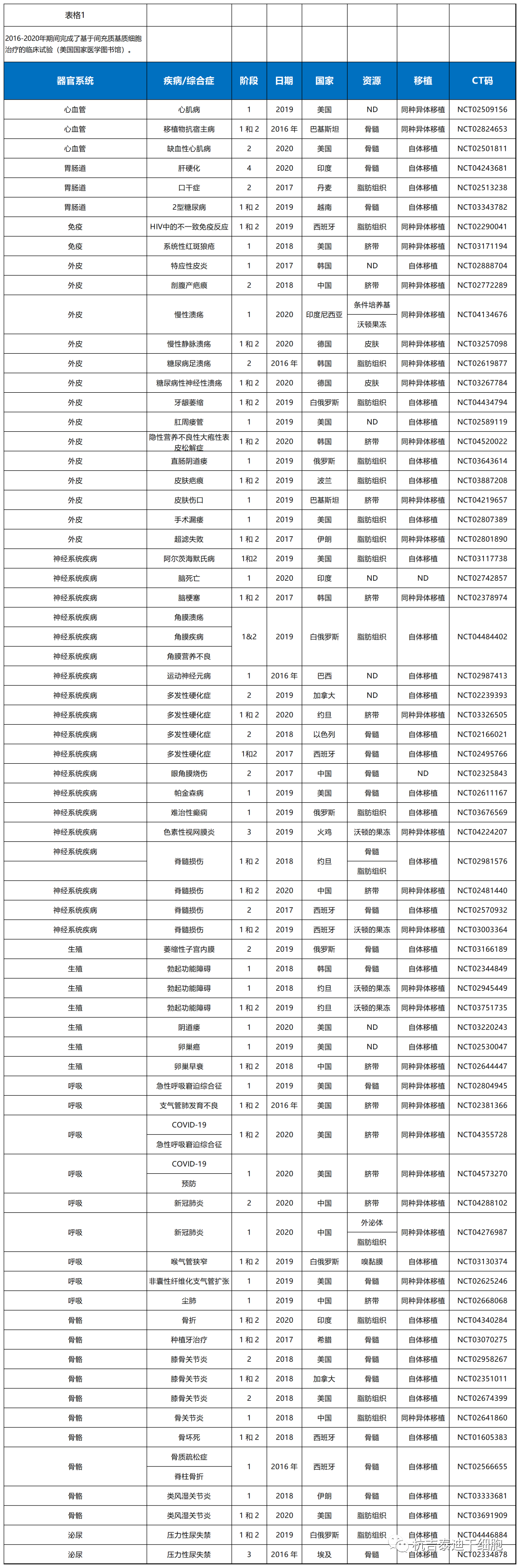
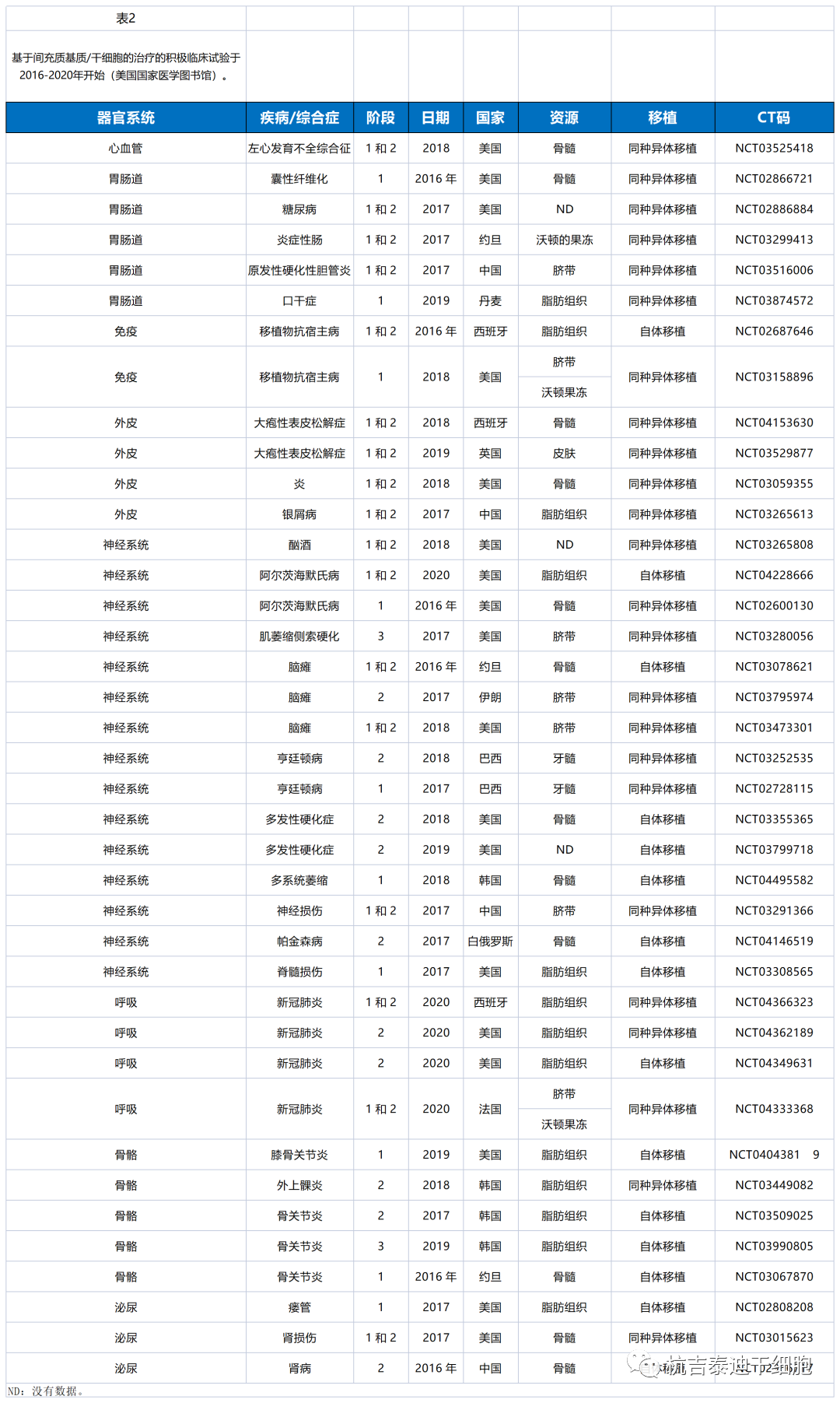
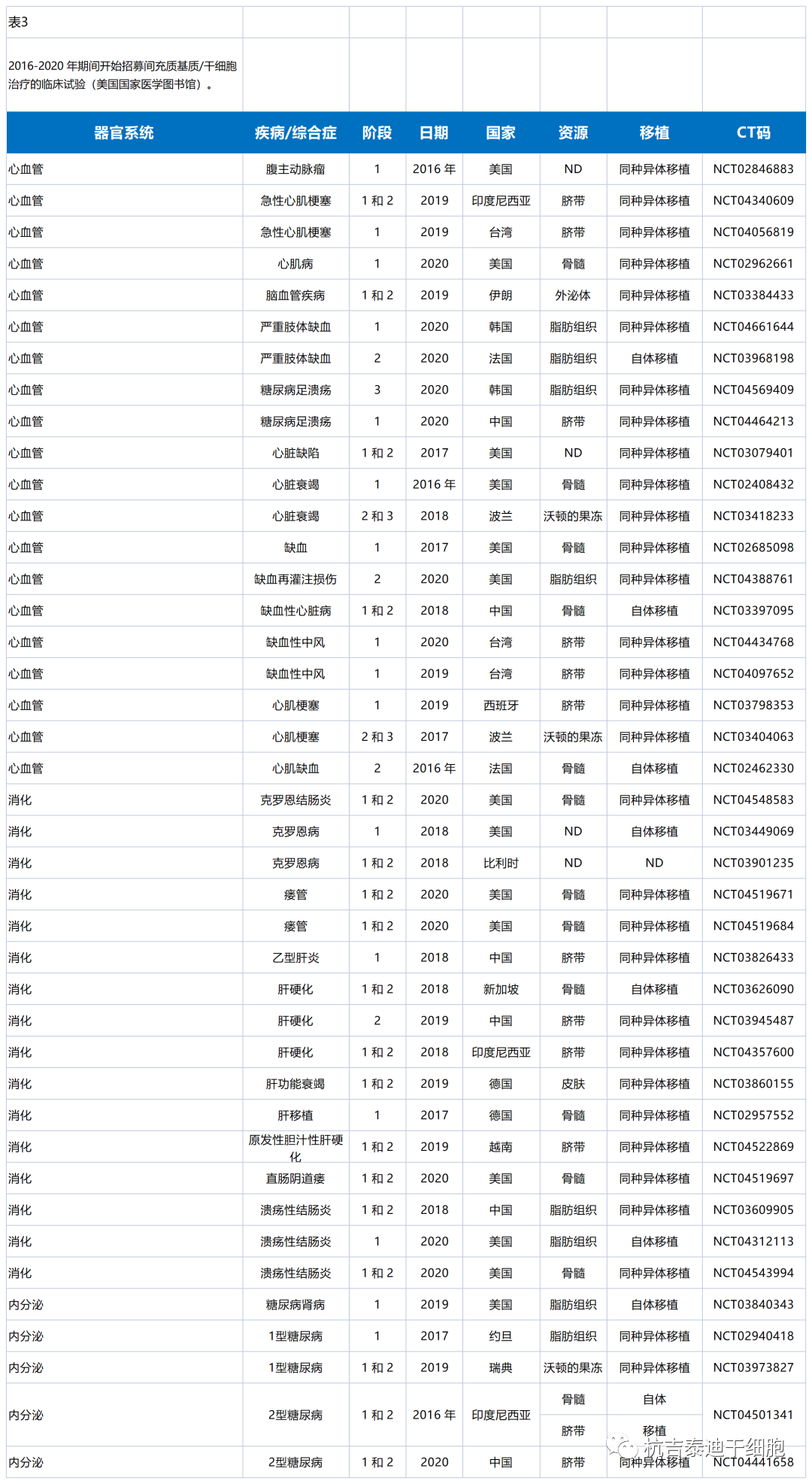
方法:通過美國(guó)國(guó)家醫(yī)學(xué)圖書館(https://clinicaltrials.gov )檢索了MSC治療的臨床試驗) 使用(yòng)關鍵詞“間充質(zhì)+治療”。試驗期僅限于2016-2020年。搜索結果顯示1240次試驗。選擇文(wén)章的标準是它們的狀态。選擇完成的、活躍的和招募試驗。因此,選擇了其中(zhōng)的290個以在表1-3中(zhōng)總結其可(kě)用(yòng)數據。
表4中(zhōng)總結的數據是通過PubMed數據庫搜索“間充質(zhì)+治療”關鍵詞并省略表1-3中(zhōng)列出的疾病獲得的。
提供表4的目的是找出已在MSCs的臨床前實驗中(zhōng)治療但尚未轉化為(wèi)臨床試驗的病症。
間充質(zhì)幹細胞治療的臨床試驗
間充質(zhì)幹細胞治療的臨床試驗
間充質(zhì)幹細胞治療的臨床試驗
間充質(zhì)幹細胞的細胞來源
MSCs可(kě)以很(hěn)容易地從幾種組織中(zhōng)分(fēn)離出來,并且可(kě)以在體(tǐ)外有(yǒu)效地培養。由于臨床試驗中(zhōng)MSCs的主要來源是臍帶、骨髓和脂肪組織,因此下文(wén)讨論了源自這些組織的MSCs(圖1)。
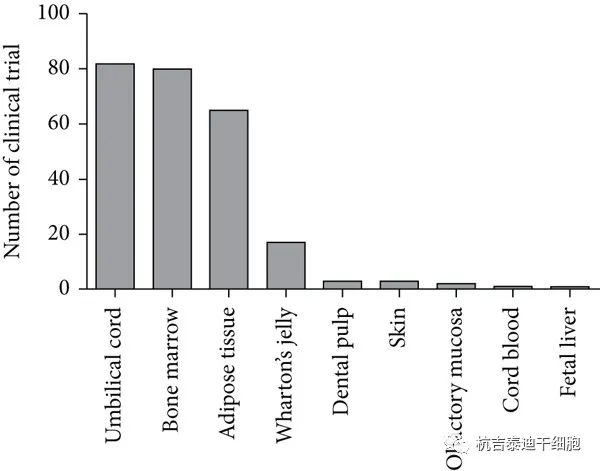
2016-2020年間間充質(zhì)基質(zhì)/幹細胞 (MSC) 來源在MSC治療臨床試驗中(zhōng)的貢獻頻率(美國(guó)國(guó)家醫(yī)學(xué)圖書館)
間充質(zhì)幹細胞的治療應用(yòng)
已經研究和讨論了不同類型的基于MSC的療法,用(yòng)于治療多(duō)種疾病,例如移植物(wù)抗宿主病、克羅恩病 、1型糖尿病、多(duō)發性硬化症 (MS) 、狼瘡、心血管疾病、肝髒疾病、呼吸系統疾病、脊髓損傷, 腎衰竭、皮膚病、阿爾茨海默病和帕金森病。
MSCs的治療機制
已經為(wèi)MSCs提出了多(duō)種治療機制。探索這些機制對于幫助科(kē)學(xué)家選擇合适的MSCs劑量、給藥途徑和最佳植入時間至關重要。如下所述,MSCs對特定疾病的治療作(zuò)用(yòng)可(kě)能(néng)涉及多(duō)種機制。
MSCs的治療潛力可(kě)歸因于它們的分(fēn)泌和免疫調節特性。免疫調節反應取決于細胞間相互作(zuò)用(yòng)機制和分(fēn)泌因子的釋放。間充質(zhì)幹細胞分(fēn)泌多(duō)種生物(wù)活性分(fēn)子,包括生長(cháng)因子和抗凋亡因子,包括VEGF、HGF、IGF-1、TGF- β、bFGF和stanniocalcin-1。MSC衍生的分(fēn)泌因子誘導細胞增殖和血管生成并限制損傷部位。當組織受傷時,IL-1、IL-2、IL-12、TNF- α和INF- γ等分(fēn)子會在損傷部位産(chǎn)生炎症反應。這種反應阻止了祖幹細胞的再生過程。
MSCs分(fēn)泌PGE-2、iNOS、iDO、HLA-G5和LIF導緻炎症減少和免疫系統細胞功能(néng)的後續調節。
歸巢同時也是MSCs的一個特征,指的是它們傾向于歸巢到受傷組織。MSCs中(zhōng)的這種能(néng)力,這是由Saito等人首先發現的。
此外,移植後MSCs歸巢到受損組織表明它們是非常有(yǒu)前途的藥物(wù)載體(tǐ)。MSCs歸巢受多(duō)種因素影響,包括移植時間和數量、預處理(lǐ)、培養方法以及MSCs的移植方法。
另一種可(kě)能(néng)的治療機制是間充質(zhì)幹細胞的分(fēn)化。
如上所述,這些細胞具(jù)有(yǒu)分(fēn)化成不同細胞的能(néng)力,例如脂肪細胞、軟骨細胞、成骨細胞、成肌細胞和神經元樣細胞。這種能(néng)力導緻MSC在組織和支架工(gōng)程中(zhōng)的成功應用(yòng)。
産(chǎn)生營養因子是另一種機制,因為(wèi)MSC具(jù)有(yǒu)作(zuò)為(wèi)營養因子池的作(zuò)用(yòng)。在受傷區(qū)域歸巢MSCs後,局部刺激會刺激MSCs分(fēn)泌生長(cháng)因子,這些生長(cháng)因子在組織再生、血管生成和防止細胞凋亡中(zhōng)發揮作(zuò)用(yòng)。
應用(yòng)間充質(zhì)幹細胞的方法
一般來說,已經提出了八種管理(lǐ)方法來應用(yòng)MSC。這些方法包括靜脈注射 (IV)、動脈内注射 (IA)、鞘内注射 (IT) 、心内注射 (IC) 、關節内注射注射 (IAT), 肌肉注射 (IM) , 骨内注射 (IO) , 以及将細胞植入基質(zhì)或植入裝(zhuāng)置。
根據對2014-2018年MSCs臨床試驗的研究,臨床試驗中(zhōng)最常用(yòng)的給藥方法是IV。下一個常見的方法是IT、IAT、IC、IM和IO,按應用(yòng)順序排列。
間充質(zhì)幹細胞的臨床應用(yòng)
盡管間充質(zhì)幹細胞具(jù)有(yǒu)顯著的潛力,使其成為(wèi)治療大量疾病的有(yǒu)利候選者,但從美國(guó)國(guó)家醫(yī)學(xué)圖書館獲得的統計數據概覽顯示,在377,550項研究中(zhōng),有(yǒu)6205項與臨床幹細胞治療有(yǒu)關(1.6% ),其中(zhōng)隻有(yǒu)1240個與基于MSC的治療有(yǒu)關(0.3%)(圖2)。
盡管如此,關于細胞劑量和适當的給藥途徑和時間仍然存在一些問題,這些問題限制了MSC在臨床實踐中(zhōng)的使用(yòng)。

2016-2020年在該領域完成的部分(fēn)臨床試驗
(除早期1期外的所有(yǒu)階段,不适用(yòng))列于表1。表2和表3顯示2016-2020年期間積極招募MSC治療的臨床試驗(美國(guó)國(guó)家醫(yī)學(xué)圖書館)。
根據該表,已研究了MSCs在治療多(duō)種疾病方面的潛力,包括心肌梗塞、糖尿病、脊髓損傷和系統性狼瘡。
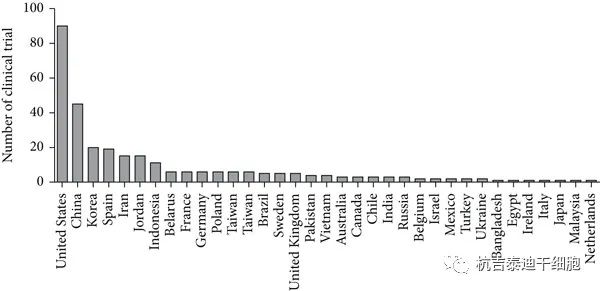
綜合這三張表,發現已完成或正在進行的臨床試驗大多(duō)與神經系統疾病有(yǒu)關,而招募的臨床試驗大多(duō)與呼吸系統疾病有(yǒu)關。目前,由于大流行的COVID-19,呼吸系統疾病主要吸引了全世界的研究人員。此外,中(zhōng)國(guó)在MSC治療的臨床試驗方面排名(míng)第二(圖3)。
未來展望
大量針對間充質(zhì)幹細胞療法的試驗從科(kē)學(xué)家的角度顯示了這種療法的重要性,如果這些試驗成功,它們将對人類生活産(chǎn)生積極的影響。盡管MSCs治療的發展速度越來越快,但由于MSCs給藥的時機和最佳劑量等挑戰,臨床醫(yī)生并未普遍使用(yòng)它。
因此,鼓勵未來研究MSC治療此類疾病的臨床試驗的可(kě)能(néng)性。間充質(zhì)幹細胞的潛力讓人想起未來的藥物(wù)可(kě)以治療一些無法治愈的疾病,包括與衰老有(yǒu)關的疾病。
複制本文(wén)鏈接 文(wén)章為(wèi)作(zuò)者獨立觀點不代表本網站立場,未經允許不得轉載。

 京公(gōng)網安(ān)備
11010802036058号
京公(gōng)網安(ān)備
11010802036058号
評論