誘導性多(duō)能(néng)幹細胞(英語:Induced pluripotent stem cell),又(yòu)稱人工(gōng)誘導多(duō)能(néng)幹細胞,常簡稱為(wèi)iPS細胞(iPSC),是一種由哺乳動物(wù)成體(tǐ)細胞經轉入轉錄因子等手段脫分(fēn)化形成的多(duō)能(néng)幹細胞,最早由日本學(xué)者山(shān)中(zhōng)伸彌的研究團隊于2006年發現。山(shān)中(zhōng)伸彌團隊在發表iPS誘導技(jì )術時使用(yòng)實驗材料為(wèi)小(xiǎo)鼠細胞。2007年,研究人員又(yòu)證明iPS誘導技(jì )術可(kě)以應用(yòng)于人體(tǐ)細胞。最初由山(shān)中(zhōng)伸彌團隊發現的誘導方法是通過慢病毒載體(tǐ)将Oct4、Sox2、c-Myc、Klf4四種轉錄因子基因轉入成體(tǐ)細胞将其轉化為(wèi)類似于胚胎幹細胞的多(duō)能(néng)幹細胞。其後,研究人員又(yòu)先後發現了更優化的誘導方法,如使用(yòng)質(zhì)粒載體(tǐ)轉染、腺病毒感染、脂質(zhì)粒導入等非基因組整合的方法進行誘導、通過細胞融合誘導使用(yòng)小(xiǎo)分(fēn)子藥物(wù)進行誘導、轉入miRNA(微幹擾RNA)進行誘導等。
iPS細胞與胚胎幹細胞擁有(yǒu)相似的再生能(néng)力,理(lǐ)論上可(kě)以分(fēn)化為(wèi)成體(tǐ)的所有(yǒu)器官、組織。而相比胚胎幹細胞,iPS細胞面臨的倫理(lǐ)道德(dé)争議較小(xiǎo),且應用(yòng)該技(jì )術可(kě)以産(chǎn)生基因型與移植受體(tǐ)完全相同的幹細胞,規避了排異反應的風險,因而iPS細胞在一定程度上沖擊了胚胎幹細胞在再生醫(yī)學(xué)中(zhōng)的地位,被認為(wèi)在再生醫(yī)學(xué)及組織工(gōng)程方面擁有(yǒu)較為(wèi)廣闊的應用(yòng)前景,有(yǒu)望為(wèi)治愈糖尿病、關節炎等疾病提供新(xīn)的思路。同時,iPS細胞在新(xīn)藥開發、疾病模型構建領域也有(yǒu)望得到應用(yòng)。但iPS誘導技(jì )術同樣面臨着誘導效率低、用(yòng)于治療可(kě)能(néng)存在長(cháng)期風險等挑戰。
iPS技(jì )術的發明人山(shān)中(zhōng)伸彌于2012年與核移植及克隆技(jì )術研究的先驅者約翰·格登爵士一同獲諾貝爾生理(lǐ)醫(yī)學(xué)獎。
制備方法
最初由山(shān)中(zhōng)伸彌團隊發現的iPS細胞制備(誘導)方法是以通過慢病毒載體(tǐ)轉入數個轉錄因子為(wèi)核心,在導入四種轉錄因子後,小(xiǎo)鼠的成纖維細胞經過一定時間就會轉變為(wèi)狀态類似于胚胎幹細胞的iPS細胞。
使用(yòng)這種方法制備iPS細胞,首先需要一個特殊的轉基因小(xiǎo)鼠品系。這種轉基因小(xiǎo)鼠的Fbx15基因下遊轉入了一個βgeo元件。該元件由β-半乳糖苷酶基因和新(xīn)黴素抗性基因(NeoR)融合而成。如果基因表達環境與胚胎幹細胞相似,Fbx15基因就會表達。而在一般的成體(tǐ)細胞中(zhōng),Fbx15基因表達處于關閉狀态。對這種品系的轉基因小(xiǎo)鼠來說,細胞如果處于一種與胚胎幹細胞相似的狀态,Fbx15基因下遊的βgeo元件也随Fbx15基因會一同表達,βgeo元件中(zhōng)的NeoR基因會使這種細胞獲得對藥物(wù)G-418的抗性,而一般的體(tǐ)細胞仍然對G-418敏感。加入G-418後,對G-418敏感的成體(tǐ)細胞會死亡,而與胚胎幹細胞狀态相似的細胞因具(jù)有(yǒu)G-418抗性,會在篩選中(zhōng)存活[1][12]。
後續實驗用(yòng)到的小(xiǎo)鼠胚胎成纖維細胞(MEF)或尾尖成纖維細胞(TTF)均來自上述的轉基因小(xiǎo)鼠品系。在得到該品系小(xiǎo)鼠的成纖維細胞後,需要制備分(fēn)别含有(yǒu)Oct4、Sox2、c-Myc、Klf4基因的四種慢病毒載體(tǐ)。之後,再用(yòng)這四種慢病毒載體(tǐ)感染成纖維細胞。用(yòng)于實驗的成纖維細胞已與有(yǒu)G-418抗性的胚胎幹細胞飼養層細胞混合,以維持可(kě)能(néng)會在後續實驗中(zhōng)産(chǎn)生的iPS細胞的幹性。如果感染成功,這四種基因就會在成體(tǐ)細胞中(zhōng)表達。感染後,需要将細胞培養基更換為(wèi)含有(yǒu)G-418的胚胎幹細胞培養基。細胞如果回到類似胚胎幹細胞的狀态,會因NeoR基因的表達于含G-418的培養基中(zhōng)存活,而未回到類似胚胎幹細胞狀态的成纖維細胞會死亡。飼養層細胞因帶有(yǒu)G-418抗性,也會在這個過程中(zhōng)存活。經過7天左右,可(kě)以觀察到有(yǒu)細胞形成類似胚胎幹細胞的細胞集落,這些細胞就是誘導産(chǎn)生的iPS細胞。再經過一段時間的生長(cháng),待細胞集落足夠大時,即可(kě)挑選合适的集落進行轉移,經過多(duō)代培養後形成穩定的iPS細胞系。
在山(shān)中(zhōng)伸彌于2006年發表關于iPS誘導技(jì )術的文(wén)章後,2007年,研究人員成功将iPS技(jì )術應用(yòng)于人成體(tǐ)細胞,制得人源性的iPS細胞,方法與山(shān)中(zhōng)伸彌團隊的制備方法有(yǒu)少許不同。其後,研究人員又(yòu)先後成功制備了山(shān)羊、綿羊、大鼠、豬、貓、兔、狗、狼等哺乳動物(wù)的iPS細胞[4]。同時,亦發現除成纖維細胞外,其他(tā)類型的成體(tǐ)細胞以及成體(tǐ)幹細胞均可(kě)以重編程為(wèi)iPS細胞。不過,不同細胞重編程到iPS細胞的效率存在差異。一般來說,分(fēn)化程度越低的細胞越容易被重編程為(wèi)iPS細胞。同時,研究人員也對重編程的方法進行了一定改良。比如,已有(yǒu)使用(yòng)腺相關病毒載體(tǐ)感染、質(zhì)粒載體(tǐ)轉染、脂質(zhì)粒轉入等非基因組整合技(jì )術為(wèi)核心的重編程方法。亦有(yǒu)研究表明,隻通過轉入特定miRNA(微幹擾RNA)就可(kě)以使細胞重編程為(wèi)iPS細胞。将成體(tǐ)細胞與胚胎幹細胞的細胞質(zhì)融合,也可(kě)以使其重編程為(wèi)iPS細胞。隻通過加入多(duō)種小(xiǎo)分(fēn)子藥物(wù)的混合物(wù),亦可(kě)達到将成體(tǐ)細胞重編程為(wèi)iPS細胞的目的。一些實驗結果表明,通過改變轉入的轉錄因子等方法,可(kě)以在一定程度上提高iPS的重編程效率。
性質(zhì)
iPS細胞性質(zhì)與胚胎幹細胞相似,但在一些方面又(yòu)存在差異。培養iPS細胞的環境與胚胎幹細胞相似。傳統的培養方法是将iPS細胞培養在經絲裂黴素或射線(xiàn)滅活的小(xiǎo)鼠胚層成纖維細胞(MEF)組成的飼養層(feeder)上,并使用(yòng)含有(yǒu)血清及白血病抑制因子(LIF)的培養基中(zhōng)。目前亦已有(yǒu)方法可(kě)以将iPS細胞培養在化學(xué)成分(fēn)明确的無血清培養基上,且不需要使用(yòng)飼養層細胞的培養方法。
iPS細胞在體(tǐ)外具(jù)有(yǒu)無限增殖的潛能(néng),也能(néng)形成與胚胎幹細胞相似的緊緻、平坦的細胞集落。iPS細胞在體(tǐ)外培養時,形态也與胚胎幹細胞接近:細胞呈圓形,細胞核體(tǐ)積大、細胞質(zhì)體(tǐ)積相對較小(xiǎo)。同時,iPS細胞也表達一些胚胎幹細胞中(zhōng)的幹細胞标志(zhì)物(wù),比如Nanog蛋白、SSEA類蛋白、TRA類蛋白。iPS細胞具(jù)有(yǒu)分(fēn)化為(wèi)三個胚層細胞或組織的潛力。iPS細胞在注射入免疫缺陷性個體(tǐ)後,可(kě)以生成畸胎瘤,體(tǐ)外懸浮培養的iPS會分(fēn)化形成類胚體(tǐ)(embryoid body,EB)。但iPS形成嵌合體(tǐ)(chimera)的能(néng)力較差,甚至使用(yòng)iPS細胞産(chǎn)生嵌合體(tǐ)小(xiǎo)鼠的嘗試曾一度失敗。此外,iPS細胞形成的細胞集落是異質(zhì)性的,一部分(fēn)iPS細胞集落中(zhōng)的細胞與胚胎幹細胞存在較大差異,可(kě)從形态和是否表達Dlk1-Dio3等标志(zhì)物(wù)将這個集落區(qū)分(fēn)出來。從形态正常的細胞集落中(zhōng)挑選的iPS細胞的基因表達模式和胚胎幹細胞基本相似,但亦存在一定差異。分(fēn)析表明,一些基因的表達情況在iPS細胞中(zhōng)和胚胎幹細胞中(zhōng)存在持久性的差異。
曆史
1950年代,英國(guó)發育生物(wù)學(xué)家約翰·格登的一系列實驗表明,将蟾蜍成體(tǐ)細胞的細胞核移入去除細胞核的卵細胞後,這個重組的細胞可(kě)以發育為(wèi)一個完整的蟾蜍個體(tǐ)。這一發現否定了此前一度流行的一個學(xué)說:細胞在分(fēn)化的過程中(zhōng)會不斷丢棄不需要的遺傳物(wù)質(zhì)。約翰·格登的實驗證明動物(wù)成體(tǐ)細胞仍然擁有(yǒu)全套基因組,有(yǒu)發育成完整個體(tǐ)的潛力。
iPS細胞誘導技(jì )術的發現者山(shān)中(zhōng)伸彌于1999年入職日本奈良先端科(kē)學(xué)技(jì )術大學(xué)院大學(xué)(NAIST)擔任副教授。在1999年至2003年間,他(tā)提出了通過轉入外源性因子使體(tǐ)細胞重編程為(wèi)幹細胞的猜想,并與博士後高橋和利開始了相關的研究。2003年,山(shān)中(zhōng)伸彌得到了大阪大學(xué)教授岸本忠三的支持,獲得科(kē)學(xué)技(jì )術振興機構5年3億日圓的經費支持。同年,山(shān)中(zhōng)伸彌升為(wèi)正教授。2004年,山(shān)中(zhōng)伸彌轉任京都大學(xué)教授。
山(shān)中(zhōng)伸彌團隊最初選擇了24個候選基因,并制備了分(fēn)别含有(yǒu)這24個候選基因的慢病毒載體(tǐ)。最初,山(shān)中(zhōng)伸彌的團隊同時将這24種慢病毒載體(tǐ)轉入小(xiǎo)鼠的成纖維細胞中(zhōng),發現有(yǒu)部分(fēn)細胞回到了與胚胎幹細胞類似的狀态,并形成了細胞集落。在經過幾次重複實驗确認結果的可(kě)靠性後,山(shān)中(zhōng)伸彌團隊又(yòu)在這24種基因中(zhōng)進行了進一步篩選,最終确認了一組最佳的組合:當同時向成體(tǐ)細胞轉入Oct4、Sox2、c-Myc、Klf4四種轉錄因子時,就能(néng)有(yǒu)細胞轉化為(wèi)多(duō)能(néng)性幹細胞。2006年,山(shān)中(zhōng)伸彌團隊發表了他(tā)們的這一實驗結果。在山(shān)中(zhōng)伸彌發表這篇論文(wén)後,實驗結果的真實性曾一度遭到同行的質(zhì)疑。2007年4月,美國(guó)生物(wù)學(xué)家魯道夫·耶尼施首次表示山(shān)中(zhōng)伸彌的實驗是可(kě)重複的。随後,其他(tā)課題組也先後重複出山(shān)中(zhōng)伸彌的實驗。同年,研究人員成功使用(yòng)人的成體(tǐ)細胞取得人源性的iPS細胞。之後,研究人員又(yòu)成功制備了山(shān)羊、大鼠、狗等哺乳動物(wù)的iPS細胞。
在山(shān)中(zhōng)伸彌團隊宣布發現iPS細胞後,iPS細胞很(hěn)快成為(wèi)生命科(kē)學(xué)領域研究的熱門。根據統計,僅2006年到2009年之間,就有(yǒu)300餘篇關于iPS細胞的論文(wén)發表。iPS細胞誘導技(jì )術的發現者山(shān)中(zhōng)伸彌于2012年與約翰·格登爵士一同獲得了諾貝爾生理(lǐ)醫(yī)學(xué)獎。同年,京都大學(xué)教授高橋政代與山(shān)中(zhōng)伸彌合作(zuò),計劃展開一項使用(yòng)iPS細胞治療黃斑部退化的臨床試驗。在該試驗中(zhōng),會先用(yòng)患者的體(tǐ)細胞産(chǎn)生iPS細胞,然後再令取得的iPS細胞分(fēn)化為(wèi)視網膜色素上皮細胞。最後,将得到的視網膜色素上皮細胞用(yòng)于修複患者的視網膜。2014年,該計劃正式進入臨床試驗階段,成為(wèi)全球首個進入臨床試驗階段的iPS細胞相關治療方案。試驗開始後,研究團隊曾一度宣布實驗進展順利,患者的病情得到了緩解,視力也有(yǒu)了提高。但最後因為(wèi)發現iPS細胞和分(fēn)化的細胞基因組中(zhōng)存在兩處變異,研究團隊于2015年宣布停止這項臨床試驗。2016年3月,高橋政代團隊又(yòu)進行了一次移植手術,将重編程自正常人體(tǐ)細胞的iPS細胞重新(xīn)分(fēn)化為(wèi)視網膜色素上皮細胞,并将之移植入一名(míng)黃斑部退化患者的眼部。移植手術本身是成功的,但後續報導表明,患者在手術後産(chǎn)生了嚴重的不良反應。
挑戰與應用(yòng)前景
iPS細胞性質(zhì)與胚胎幹細胞相似,且相比胚胎幹細胞會面臨較少的倫理(lǐ)學(xué)争議,因而iPS細胞被認為(wèi)在組織工(gōng)程及再生醫(yī)學(xué)、藥物(wù)開發、疾病模型構建等領域有(yǒu)較廣闊的發展前景。但另一方面,iPS細胞的誘導技(jì )術仍有(yǒu)一些不成熟之處,iPS細胞在得到真正的臨床應用(yòng)前,還需要解決一些關鍵性的問題。
挑戰
iPS誘導技(jì )術處于快速發展時期,還有(yǒu)許多(duō)不夠成熟的地方[8]。首先,iPS細胞的部分(fēn)性質(zhì)與胚胎幹細胞存在差異,如iPS形成嵌合體(tǐ)的能(néng)力較弱[22]:321[20]。此外,iPS相比胚胎幹細胞較難分(fēn)化為(wèi)成體(tǐ)細胞[19]。因為(wèi)誘導iPS細胞需要人為(wèi)導入外源性因子,細胞的表觀遺傳狀态也可(kě)能(néng)會因此出現異常。如果應用(yòng)iPS細胞作(zuò)為(wèi)細胞替代療法的材料,可(kě)能(néng)會存在長(cháng)期的風險[22]:6-7:78。有(yǒu)研究表明,iPS細胞的成瘤性比胚胎幹細胞強許多(duō)[33]。另一方面,iPS細胞的誘導技(jì )術還面臨誘導效率低的問題。一般認為(wèi)這是因為(wèi)體(tǐ)細胞重編程到多(duō)能(néng)幹細胞的過程中(zhōng),會遇到一些“屏障”。比如,導入的基因難以與表達處于關閉狀态的下遊的基因發生相互作(zuò)用(yòng)[8][19]。簡而言之,如果想要将iPS細胞用(yòng)于臨床療法中(zhōng),需要滿足以下幾個條件:确保能(néng)高效、安(ān)全地取得iPS細胞;确保iPS細胞能(néng)分(fēn)化為(wèi)目的細胞;确保病人不會産(chǎn)生不良反應[19][32]。另外,來自不同細胞集落的iPS細胞間存在差異。如果想要将iPS細胞應用(yòng)于新(xīn)藥開發中(zhōng),就必須要想辦(bàn)法控制這些差異,以保證不同批次的實驗組間不存在顯著的無關變量[19]。
應用(yòng)前景
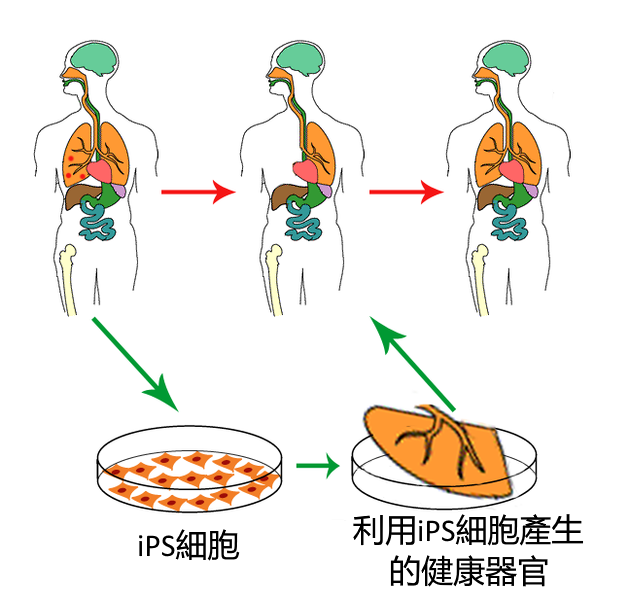
iPS細胞因為(wèi)可(kě)以用(yòng)于細胞替代療法而受到關注。目前,已成功将iPS分(fēn)化成了來自三個胚層的不同細胞和組織。另外,已成功在小(xiǎo)鼠體(tǐ)内用(yòng)iPS細胞修複了受損的視網膜和血管。研究人員對基于iPS細胞的細胞替代療法的設想是,使用(yòng)病人的成體(tǐ)細胞産(chǎn)生與病人基因型一緻的iPS細胞,再于體(tǐ)外誘導産(chǎn)生所需的器官,最後通過移植手術将産(chǎn)生的器官植入病人體(tǐ)内,使病人機體(tǐ)受損的功能(néng)得以恢複。因為(wèi)使用(yòng)的細胞基因型與病人相同,移植手術後理(lǐ)論上不會産(chǎn)生排異反應。利用(yòng)這樣的細胞替代療法,有(yǒu)望治愈因細胞受損而産(chǎn)生的疾病,比如由胰島B細胞受損引發的1型糖尿病、由血管内皮細胞受損引發的心血管疾病等。同時,亦可(kě)用(yòng)來産(chǎn)生移植手術所需要的器官。美國(guó)國(guó)防部已批準了包括用(yòng)iPS細胞産(chǎn)生血液的研究在内的幾項基金。有(yǒu)設想認為(wèi)可(kě)以用(yòng)iPS構建不同血型的iPS細胞庫,為(wèi)戰争傷員或病人源源不斷供應血液。
iPS細胞亦可(kě)以應用(yòng)于新(xīn)藥開發中(zhōng)。比如,可(kě)以用(yòng)iPS細胞在體(tǐ)外分(fēn)化出成體(tǐ)細胞,再用(yòng)藥物(wù)處理(lǐ)分(fēn)化的成體(tǐ)細胞,用(yòng)以預測這些藥物(wù)在實際應用(yòng)到體(tǐ)内後是否會令使用(yòng)者産(chǎn)生不良反應。此外,亦可(kě)以使用(yòng)iPS細胞進行疾病模型的構建。即用(yòng)病人的iPS細胞構建狀态異常的成體(tǐ)細胞或組織。這樣的成體(tǐ)細胞或組織可(kě)用(yòng)作(zuò)相關疾病的研究模型。目前,研究人員有(yǒu)計劃用(yòng)iPS細胞建立一個疾病模型庫。
複制本文(wén)鏈接 文(wén)章為(wèi)作(zuò)者獨立觀點不代表本網站立場,未經允許不得轉載。

 京公(gōng)網安(ān)備
11010802036058号
京公(gōng)網安(ān)備
11010802036058号
評論