近期,北京醫(yī)院啓動了一項新(xīn)的宮腔黏連創新(xīn)療法臨床試驗,該臨床試驗由婦産(chǎn)科(kē)王少為(wèi)教授團隊主導,為(wèi)難治性宮腔黏連的臨床治療提供一個全新(xīn)、安(ān)全、有(yǒu)效的創新(xīn)性治療方案,并公(gōng)開招募參與臨床的患者。(文(wén)後附有(yǒu)招募信息供聯系)
宮腔粘連,又(yòu)稱為(wèi)Asherman綜合征,是一種常見的子宮内膜損傷性疾病,已經成為(wèi)女性繼發性不孕的第二大病因。近日,發表于《Stem Cell Research & Therapy》的一篇綜述提出[1],細胞療法能(néng)夠治療包括薄型子宮内膜和宮腔粘連在内的許多(duō)疾病;尤其是臍帶間充質(zhì)幹細胞,具(jù)有(yǒu)容易獲得,快速自我更新(xīn),以及免疫原性低等優勢,基于幹細胞與生物(wù)材料結合的創新(xīn)療法被認為(wèi)是再生子宮内膜的理(lǐ)想選擇。

宮腔粘連由多(duō)種因素導緻宮腔内和宮頸管基底層内膜損傷後,宮腔肌壁與頸管之間發生相互粘連而形成。由于人工(gōng)流産(chǎn)等侵入性宮腔操作(zuò)的增多(duō),目前宮腔粘連的發病率也日益上升。目前,針對宮腔粘連的治療手段包括通過手術松解粘連内膜,放置生物(wù)材料防治再粘連以及使用(yòng)雌激素,阿司匹林等促進子宮内膜修複。然而,這些治療手段要麽無法根治要麽存在各種副作(zuò)用(yòng)。因此,迫切需要研發新(xīn)的治療方案。
幹細胞,作(zuò)為(wèi)一種具(jù)有(yǒu)多(duō)向分(fēn)化潛能(néng)及分(fēn)泌多(duō)種功能(néng)性因子的細胞,被認為(wèi)可(kě)應用(yòng)于治療不孕症相關疾病。幹細胞治療因宮腔粘連引起的不孕症的機制主要是通過細胞因子的誘導、生長(cháng)因子的産(chǎn)生促進内膜修複與再生;以及通過免疫調節特性使得自然殺傷細胞活性的降低、Th17和Th1的減少、Treg細胞和Th2的增加。
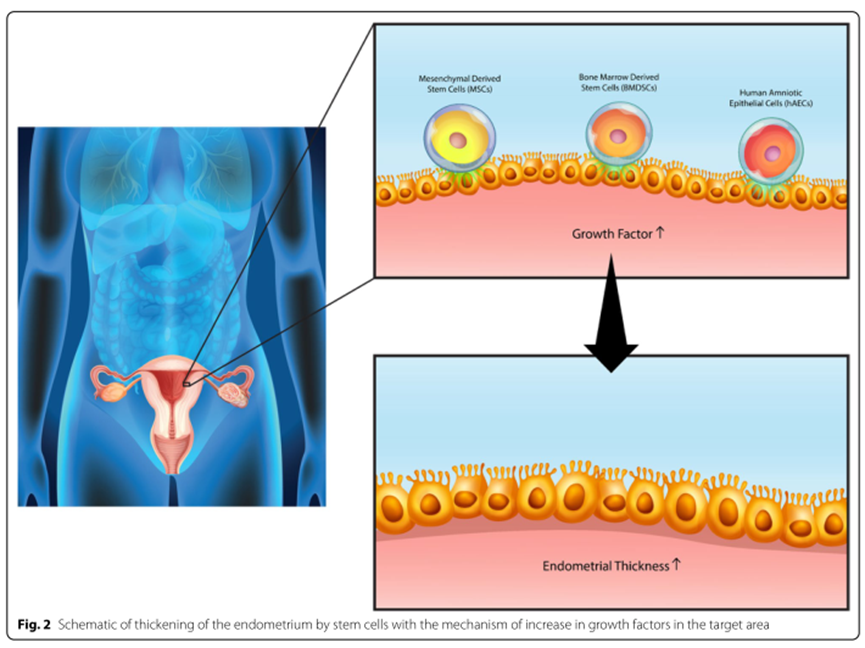
圖片來自文(wén)獻[1]
案例分(fēn)享:幹細胞治療宮腔粘連
近年來,在理(lǐ)論研究及臨床前試驗取得一定成果的前提下,國(guó)内外研究人員陸續開展了多(duō)項幹細胞治療宮腔粘連的臨床研究,結果表明,幹細胞治療宮腔粘連引起不孕症安(ān)全有(yǒu)效,有(yǒu)望為(wèi)不孕症患者帶來曙光[3-5]。在臨床研究中(zhōng)使用(yòng)幹細胞來治療宮腔粘連已有(yǒu)多(duō)年,積累的成功案例也在逐年增加。
01# 8例患者圓了“生子夢”
一項由南京大學(xué)鼓樓醫(yī)院開展的前瞻性,非對照I期臨床試驗[3]評估了臍帶間充質(zhì)幹細胞治療宮腔粘連的安(ān)全性與有(yǒu)效性,相關成果發表于《Stem Cell Research & Therapy》。

研究結果表明:臍帶間充質(zhì)幹細胞可(kě)能(néng)是宮腔粘連潛在的治療方法。該研究納入26例複發性宮腔粘連導緻不孕症患者,将1×10^7個臍帶間充質(zhì)幹細胞(UC-MSCs)負載到膠原支架上,在宮腔粘連松解後移植到患者宮腔内,而後進行3個月的随訪,評估患者子宮内膜厚度、宮腔粘連評分(fēn)及子宮内膜增殖分(fēn)化相關分(fēn)子的變化。
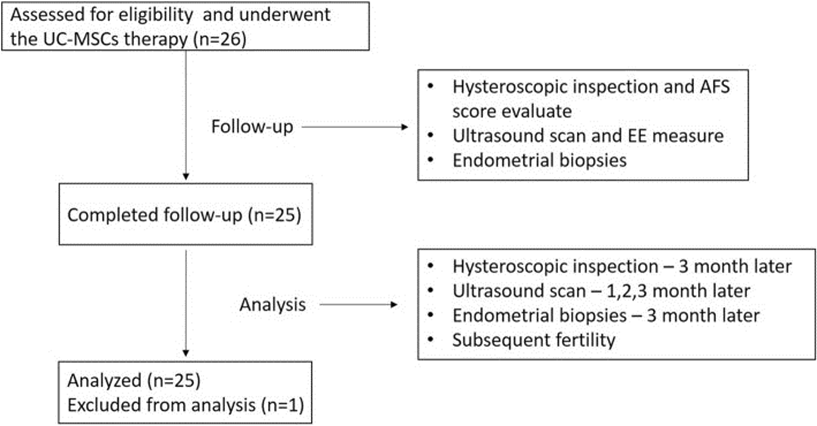
圖片來自文(wén)獻[3]
随訪結果發現[3],UC-MSCs移植後未發生與治療相關的嚴重不良事件;術後3個月,患者平均子宮内膜厚度較治療前明顯增加,宮腔粘連評分(fēn)較前降低。此外,組織學(xué)研究表明治療後子宮内膜的增殖、分(fēn)化和新(xīn)生血管均有(yǒu)改善。到30個月随訪期結束時,26例患者中(zhōng)有(yǒu)10例懷孕,其中(zhōng)8例已經分(fēn)娩,無明顯出生缺陷和胎盤并發症。
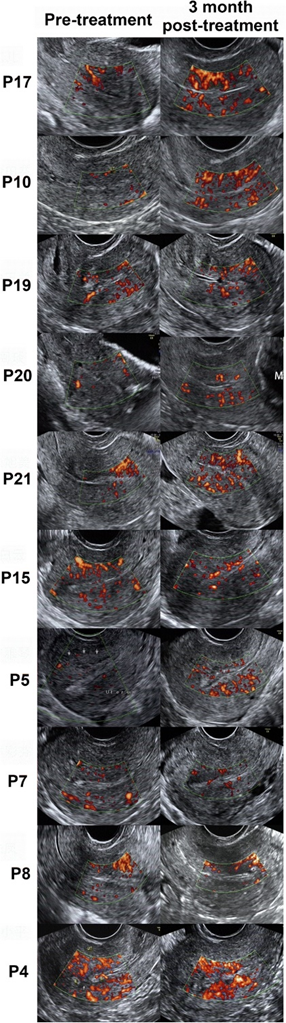
圖為(wèi)患者治療前後超聲對比 圖片來自文(wén)獻[3]
02#7名(míng)患者子宮内膜明顯恢複并成功受孕
一項由國(guó)内中(zhōng)國(guó)醫(yī)科(kē)大學(xué)盛京醫(yī)院開展的研究[4]利用(yòng)自體(tǐ)月經血間充質(zhì)幹細胞(MB-MSC)治療7名(míng)重度Asherman綜合征患者,她們均對傳統治療手段無效。在入組後她們先接受 MB-MSC 移植治療,然後接受激素治療。接受幹細胞移植後,5名(míng)患者的子宮内膜厚度顯著增加,達到 7 mm,有(yǒu)1名(míng)患者自然懷孕,2名(míng)通過輔助生殖技(jì )術受孕。
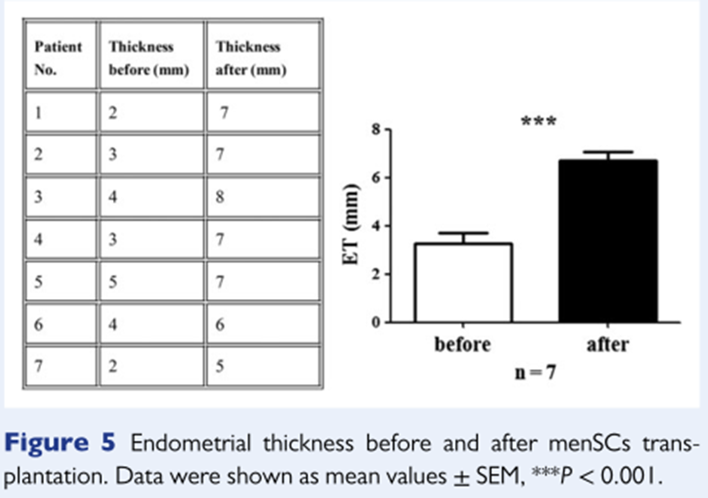
圖片來自文(wén)獻[4]
03#5名(míng)患者恢複了月經周期
另一項研究[5]的6例難治性宮腔粘連患者接受标準治療失敗後,接受了單個有(yǒu)核細胞細胞(MNCs)移植,将其植入子宮内膜下,并口服外源性雌激素治療,分(fēn)别在治療3、6以及9個月後接受子宮内膜厚度檢測。結果發現,接受細胞移植治療後,6名(míng)患者的子宮内膜厚度顯著高于治療前,并且其中(zhōng)5名(míng)患者恢複了月經周期,子宮内膜再生良好。這項研究再次表明,自體(tǐ)細胞移植是一種十分(fēn)具(jù)有(yǒu)前景的宮腔粘連治療方法。
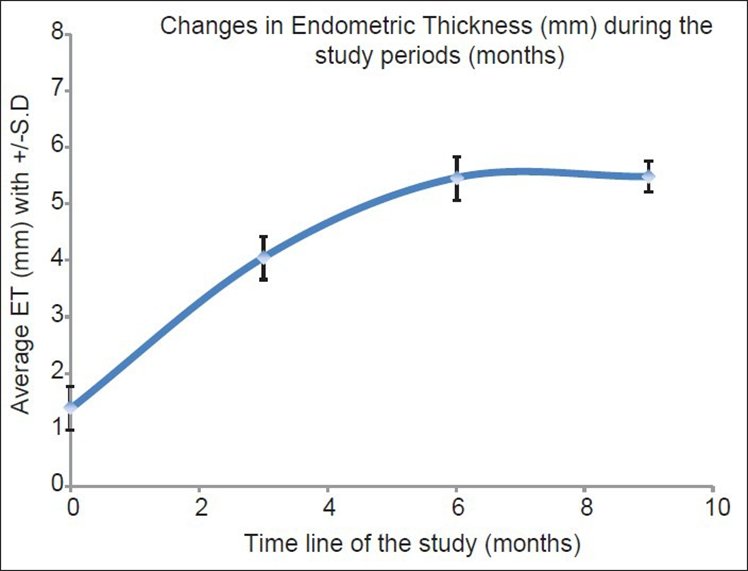
圖片來自文(wén)獻[5]
國(guó)内宮腔粘連創新(xīn)療法招募中(zhōng)
宮腔粘連讓許多(duō)夫婦飽受不孕症的困擾,無法正常孕育下一代,其傳統治療手段療效有(yǒu)限。近年來,随着科(kē)學(xué)研究證實,基于幹細胞的再生醫(yī)學(xué)手段能(néng)有(yǒu)效修複宮腔粘連患者的子宮内膜,并提高生育力。
目前,國(guó)内多(duō)個研究團隊正在開展針對宮腔粘連的創新(xīn)療法,以期為(wèi)難治性宮腔粘連的臨床治療提供一個全新(xīn)的、安(ān)全的、有(yǒu)效的治療方案。

同時,國(guó)内也有(yǒu)多(duō)項幹細胞治療子宮内膜損傷或宮腔粘連相關的備案項目。
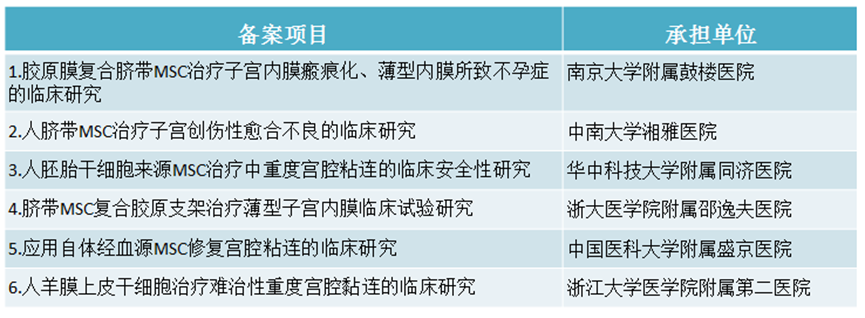
幹細胞臨床發展給宮腔粘連的治療帶來了突破,已經成功幫助一些不孕患者實現了生育的願望。目前,國(guó)内外還有(yǒu)大量的研究正在進行中(zhōng)。相信未來,幹細胞治療宮腔粘連會取得更大的進展。
參考文(wén)獻:
[1] Gharibeh N, Aghebati-Maleki L, Madani J, Pourakbari R, Yousefi M, Ahmadian Heris J. Cell-based therapy in thin endometrium and Asherman syndrome. Stem Cell Res Ther. 2022;13(1):33. Published 2022 Jan 28.
https://pubmed.ncbi.nlm.nih.gov/35090547/
[2] 陳芳,隋龍.幹細胞在宮腔粘連治療中(zhōng)的研究進展[J].國(guó)際婦産(chǎn)科(kē)學(xué)雜志(zhì),2014,41(06):632-635.
https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CJFD&dbname=CJFDLAST2015&filename=GWVC201406019&uniplatform=NZKPT&v=wCoHWLYEMXQk3pUEWubmEfB_03B8w5g7Q9fKQdekbY-cXdSYAcD69eGcs4K2EOqG
[3] Cao Y, Sun H, Zhu H, Zhu X, Tang X, Yan G, Wang J, Bai D, Wang J, Wang L, Zhou Q, Wang H, Dai C, Ding L, Xu B, Zhou Y, Hao J, Dai J, Hu Y. Allogeneic cell therapy using umbilical cord MSCs on collagen scaffolds for patients with recurrent uterine adhesion: a phase I clinical trial. Stem Cell Res Ther. 2018 Jul 11;9(1):192.
https://pubmed.ncbi.nlm.nih.gov/29996892/
[4] Tan J, Li P, Wang Q, Li Y, Li X, Zhao D, Xu X, Kong L. Autologous menstrual blood-derived stromal cells transplantation for severe Asherman's syndrome. Hum Reprod. 2016 Dec;31(12):2723-2729.
https://pubmed.ncbi.nlm.nih.gov/27664218/
[5] Singh N, Mohanty S, Seth T, Shankar M, Bhaskaran S, Dharmendra S. Autologous stem cell transplantation in refractory Asherman's syndrome: A novel cell based therapy. J Hum Reprod Sci. 2014 Apr;7(2):93-8.
https://pubmed.ncbi.nlm.nih.gov/25191021/
複制本文(wén)鏈接 文(wén)章為(wèi)作(zuò)者獨立觀點不代表本網站立場,未經允許不得轉載。

 京公(gōng)網安(ān)備
11010802036058号
京公(gōng)網安(ān)備
11010802036058号
評論