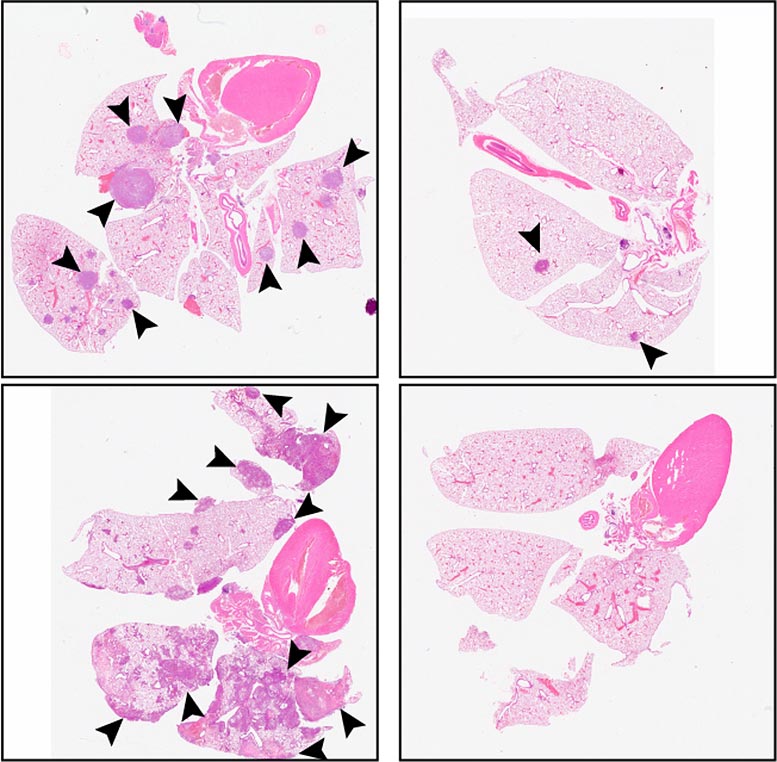
與對照(左圖)相比,C26 處理(lǐ)(右圖)減少了注射 HSNCC 細胞的小(xiǎo)鼠肺部轉移性腫瘤的數量。3Credit: © 2021 Khalil 等人。最初發表在《實驗醫(yī)學(xué)雜志(zhì)》上。https://doi.org/10.1084/jem.20210836
一種新(xīn)的治療方法通過迫使癌細胞進入無法增殖的休眠狀态來防止小(xiǎo)鼠轉移性腫瘤的生長(cháng)。這項發表在《實驗醫(yī)學(xué)雜志(zhì)》 ( JEM ) 上的研究可(kě)能(néng)會帶來新(xīn)的治療方法,以防止各種癌症類型的複發或擴散,包括乳腺癌和頭頸部鱗狀細胞癌 (HNSCC)。
許多(duō)癌症患者通常在初次治療後數年或數十年複發,并發展出新(xīn)的腫瘤,這些腫瘤在同一位置重新(xīn)生長(cháng)或轉移(擴散)到身體(tǐ)的其他(tā)部位。這些繼發性腫瘤通常對治療具(jù)有(yǒu)抗藥性,并且由單個腫瘤細胞産(chǎn)生,這些腫瘤細胞可(kě)能(néng)長(cháng)時間處于休眠狀态,然後被重新(xīn)激活以再次開始增殖。因此,如果研究人員能(néng)夠找到一種方法使剩餘的癌細胞處于休眠狀态,則可(kě)以防止患者複發。
在之前的一項研究中(zhōng),西奈山(shān)伊坎醫(yī)學(xué)院的 Maria Soledad Sosa 和現在在阿爾伯特愛因斯坦醫(yī)學(xué)院的 Julio A. Aguirre-Ghiso 發現癌細胞保持休眠的能(néng)力是由一種叫做 NR2F1 的蛋白質(zhì)控制的。 . 這種受體(tǐ)蛋白可(kě)以進入細胞核并打開或關閉許多(duō)基因以激活阻止癌細胞增殖的程序。NR2F1 水平在原發性腫瘤中(zhōng)通常較低,但在休眠的播散性癌細胞中(zhōng)升高。當癌細胞再次開始增殖并形成複發性或轉移性腫瘤時,NR2F1 蛋白的水平會再次下降。
“因此,我們認為(wèi)使用(yòng)小(xiǎo)分(fēn)子激活 NR2F1 可(kě)能(néng)是一種有(yǒu)吸引力的臨床策略,可(kě)以誘導癌細胞休眠并防止複發和轉移,”Aguirre-Ghiso 解釋說。
在新(xīn)的JEM研究中(zhōng),Sosa 和 Aguirre-Ghiso 的團隊使用(yòng)基于計算機的篩選方法來識别一種名(míng)為(wèi) C26 的藥物(wù),它可(kě)以激活 NR2F1。研究人員發現,用(yòng) C26 治療源自患者的 HNSCC 細胞會提高 NR2F1 的水平并阻止細胞增殖。
研究人員随後測試了 C26 是否會阻止小(xiǎo)鼠的轉移。注射患者來源的 HNSCC 細胞的動物(wù)通常會形成大的原發性腫瘤,在手術切除原始腫瘤後擴散到肺部。C26 治療減少了原發性腫瘤的大小(xiǎo),并且在手術後,進一步劑量的 C26 完全阻止了轉移性腫瘤的生長(cháng)。取而代之的是,齧齒動物(wù)的肺部隻含有(yǒu)一些休眠的播散癌細胞,即使在停止治療後也無法增殖。
Sosa 和 Aguirre-Ghiso 的團隊确定,通過激活 NR2F1,C26 迫使癌細胞進入以獨特的基因活動模式為(wèi)特征的長(cháng)期休眠狀态。腫瘤表現出類似基因活性模式的癌症患者往往會持續更長(cháng)時間而不會複發,這表明用(yòng) C26 類藥物(wù)誘導這種休眠程序可(kě)能(néng)對人類有(yǒu)效。
“激活 NR2F1 的藥物(wù)可(kě)能(néng)對乳腺癌特别有(yǒu)用(yòng),”Sosa 說。“與 ER 陰性腫瘤相比,NR2F1 在 ER 陽性腫瘤中(zhōng)高度富集,激活 NR2F1 可(kě)能(néng)能(néng)夠抑制通過抗雌激素療法保持在該狀态的休眠癌細胞的重新(xīn)喚醒。” 然而,由于 C26 治療提高了 NR2F1 的水平,因此該方法也可(kě)能(néng)對其他(tā)受體(tǐ)蛋白水平較低的癌症有(yǒu)用(yòng)。
“總體(tǐ)而言,我們的研究揭示了一種基于機制且設計合理(lǐ)的策略,以利用(yòng) NR2F1 激活的休眠作(zuò)為(wèi)預防轉移性複發的治療選擇,”Aguirre-Ghiso 說。
參考文(wén)獻:“NR2F1 特異性激動劑通過誘導癌細胞休眠來抑制轉移”,作(zuò)者:Bassem D. Khalil、Roberto Sanchez、Tasrina Rahman、Carolina Rodriguez-Tirado、Stefan Moritsch、Alba Rodriguez Martinez、Brett Miles、Eduardo Farias、Mihaly Mezei、Ana Rita Nobre、Deepak Singh、Nupura Kale、Karl Christoph Sproll、Maria Soledad Sosa 和 Julio A. Aguirre-Ghiso,2021 年 11 月 23 日,《實驗醫(yī)學(xué)雜志(zhì)》。
DOI: 10.1084/jem.20210836
複制本文(wén)鏈接 文(wén)章為(wèi)作(zuò)者獨立觀點不代表本網站立場,未經允許不得轉載。

 京公(gōng)網安(ān)備
11010802036058号
京公(gōng)網安(ān)備
11010802036058号
評論